
Funcionamento da Bateria Chumbo Ácida
Reações Principais
Entendendo o processo químico.
Os compostos químicos são substancias cujas moléculas elementares podem ser compostas por um ou mais átomos do mesmo elemento químico ou de elementos diferentes.
Por exemplo: O Hidrogênio é uma das substâncias mais simples que existe, porque suas moléculas são compostas por apenas dois átomos de Hidrogênio. O atomo de hidrogênio por acaso é também o mais simples pois é composto por um único próton e um único elétron que gira em torno desse núcleo formado por um único próton.
Na figura ao lado verificamos várias moléculas de água unidas entre si. (União fraca que explica apenas a viscosidade da água)
Os átomos de hidrogênio se unem ao de oxigênio, porque na última órbita de elétrons que giram em torno da molécula de oxigênio faltam dois elétrons para completar o número de oito elétrons que proporcionaria ao átomo de oxigênio a estabilidade eletrica. Dessa forma quando próximos, o eletron da ultima camada do atomo de hidrogênio é atraido pela ultima camada do átomo de oxigênio. Dessa forma esse elétron passa a fazer parte tanto da ultima camada do átomo de hidrogênio como da última camada do átomo de oxigênio. Isso faz com que fiquem imantados um ao outro. Como o atomo de oxigênio precisa de dois elétrons na ultima camada para atingir a estabilidade elétrica, atrai mais um átomo de hidrogênio, formando então um novo composto químico, que é a molécula de água.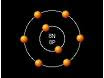
Verifique na figura ao lado a representação do átomo de oxigênio, observando que ele tem apenas seis eletrons na ultima camada, precisando portanto de mais dois elétrons para atingir o número de oito que lhe proporcionaria a estabilidade elétrica. Observa-se também que o átomo de hidrogênio passa a ter dois elétrons na ultima camada.
Todos as reações químicas da natureza se baseiam nessa lei de reação de elementos uns com os outros baseados na necessidade de conseguir a estabilidade elétrica na última camada de elétrons, que é conseguida atingindo-se o número de oito elétrons na última camada, na maioria dos elementos.
Teoria do Octeto: Um grande número de elementos adquire estabilidade eletrônica quando seus átomos apresentam oito elétrons na sua camada mais externa. Existem excessões para essa teoria como o Hidrogênio (H) e o Hélio (He), onde ambos se estabilizam com dois elétrons na última camada.
Elementos químicos envolvidos na reação química das baterias chumbo ácidas.
Além da substancia agua que é formada por dois elementos químicos, a saber, oxigênio e hidrogênio, entra também nessa reação o Enxofre cuja representação é S de "Sulphur", e chumbo cuja representação química é P de "Plumbum".
Substancias envolvidas na reação química das baterias chumbo ácidas.

O enxofre irá formar uma nova substancia que é o Ácido Sulfúrico H2SO4, uma molécula formada por dois átomos de hidrogênio, um de enxofre e quatro de oxigênio.
Observe-se que como já vimos cada átomo de Oxigênio necessita compartilhar dois elétrons na sua ultima camada. Em presença do enxofre esse compartilhamento é feito com quatro átomos de oxigênio, sendo que dois deles compartilham diretamente os dois eletrons da ultima camada, os outros dois atomos de oxigênio compartilham cada um apenas um eletron.
Para que esses dois atomos de oxigênio consigam a sua estabilidade elétrica, agregam dois atomos de hidrogênio para compartilhar os eletrons de cada um deles, completando assim sua estabilidade elétrica.
Além da água que já vimos e que irá servir de solvente para o ácido sulfúrico, teríamos ainda o peróxido de chumbo, ou PbO2, formado por um átomo de chumbo e dois de oxigênio, e que irá compor um dos eletrodos da bateria chumbo ácida, além do Chumbo própriamente dito e que irá compor o outro eletrodo.
Para entender o sistema eletroquímico envolvido em um acumulador elétrico, é necessário conhecer a físico-química das reações dos eletrodos e as influências de fatores construtivos e de materiais na cinética destas reações. As reações apresentadas neste capítulo foram extraídas de Bernet [2.1].
As baterias são acumuladores baseados na teoria da dupla sulfatação, que na sua essência indica que, durante o processo de descarga ocorre à formação de sulfato de chumbo em ambos os eletrodos. Isto pode ser representado pela Equação 2.1, que no sentido da esquerda para a direita representa o processo de descarga e no sentido inverso o de carga.
PbO2 + Pb + 2H2SO4 <=> 2PbSO4 + 2H2O
A equação mostra uma reação quando dois eletrodos sendo um de peróxido de chumbo e um de chumbo isolados entre si, são mergulhados em uma solução de ácido sulfúrico. A reação química resulta então em duas moléculas de sulfato de chumbo e duas moléculas de água.
Equação 2.1

Entretanto, algumas reações indesejáveis ocorrem em paralelo com a reação acima, como por exemplo, o processo de eletrólise da água, que provoca a evolução de oxigênio e hidrogênio nos eletrodos positivo e negativo, respectivamente. Estas reações ocorrem no processo de carga e podem ser representadas pelas equações E2.2 e E2.3.
No eletrodo positivo:
2H2O →O2 + 4H- + 4e−
A equação mostra que duas moléculas de água em presença de uma molécula de oxigênio produz 4 atomos de hidrogênio que possuem carga negativa equivalente a um elétron livre e gera 4 eletrons livres no eletrodo positivo.
Equação 2.2
2H2O + 2e− => H2 + 2OH −
A equação mostra que duas moléculas de água em presença de dois elétrons produzirá uma molécula de Hidrogênio e duas de peróxido de hidrogênio no eletrodo negativo, eliminando assim dois elétrons e tornando o eletrodo positivo.
Equação2.3
Estas reações são fortemente influenciadas pela presença de impurezas no eletrólito ou no material ativo, e principalmente pelo antimônio (Um elemento também presente na maioria das baterias chumbo ácidas). Este, ao longo da operação do acumulador, vai sendo eletrodissolvido para o eletrólito, sendo eletrodepositado na superfície das placas negativas, diminuindo sensivelmente a sobretensão de evolução do hidrogênio sobre o chumbo, facilitando desta forma a saída deste gás.
Baseada na teoria da dissociação eletrolítica, as reações que transcorrem nos eletrodos positivo (+) e negativo (-) durante o processo da descarga e da carga do acumulador podem explicar seu princípio de funcionamento da forma como segue.
Os átomos da molécula da água estão ligados entre si com maior força que os íons da molécula do ácido sulfúrico. Devido a este fato, as moléculas polares da água, agindo sobre as moléculas do ácido sulfúrico, decompõem as moléculas deste ácido em íons de hidrogênio (positivos) e íons de sulfato (negativos) segundo a reação química Equação 2.4.
H2 SO4 => 2H- + SO4−2
A equação demonstra que uma molécula de ácido sulfúrico decomposta produz duas moléculas de hidrogênio que tem carga negativa equivalente a um eletron livre e uma molécula de óxido de enxofre que tem carga negativa equivalente a dois elétrons livres.
Equação 2.4
A decomposição da molécula de ácido sulfúrico em íons pela ação da água denomina-se dissociação eletrolítica. Como resultado da dissociação eletrolítica da solução temos a formação de íons, independente de haver ou não placas imersas na solução. Como a soma das cargas dos íons positivos de hidrogênio é igual à soma das cargas negativas dos íons de sulfatos, a solução é considerando eletricamente neutra.
Verificamos então que a formação dos ions não depende da reação química que se produz nos eletrodos. É uma consequência natural da dissolução do ácido sulfúrico na água.
Estudaremos na próxima postagem o processo de descarga de uma bateria chumbo ácida.






















TUDO ISSO E ABSOLUTAMENTE CORRECTO? O PROBLEMA DA LONGEVIDADE ESTA HOGE EN DIA? NO QUE NOS ANDAM A FAZER ESQUECER NOS ULTIMOS 30 ANOS. ANTES UMA BATERIA DE CHUMBO DURAVA MAIS QUE UM CARRO! MAIS DE 10 ANOS SEM MANUTENCAO, HOJE NAO PASSA DE 1.5 ANOS. PARA FINALIZAR ESQUECERAM-SE DE FALAR NO QUE REDUZ PROPOSITADAMENTE A VIDA DAS BATERIAS DE CHUMBO.... OS SEPARADORES DE PAPEL EM BANHO DE ACIDO SULFURICO DILUIDO... COMTAMINAM AS PLACAS DE CHUMBO...COM OS CICLOS DE CARGA E DESCARGA...FICANDO CEGAS... E NEM UMA LIMPEZA AS PLACAS SULFATADAS COM OS ANOS DE USO COM ETILENO DIAMINA TETRA ACIDO ACETICO RESOLVE O TEMA!
ResponderExcluirAntigamente, lembro-me bem era possível trocar placas das baterias, e por isso elas poderiam durai indefinidamente já que trocando-se placas, limpando-se e trocando-se eletrólito, bastava ter o vaso que era o recipiente para que se tivesse uma bateria que duraria para sempre. A indústria no entanto inventou a bateria selada que não precisa trocar água e é descartável. É uma jogada comercial.
ResponderExcluirAntigamente não tinhamos tantos consumiveis igual hoje...
ResponderExcluirE a segunda parte onde esta
ResponderExcluir