O câncer é responsável por cerca de 13% de todas as causas de óbito no mundo: mais de 7 milhões de pessoas morrem anualmente da doença (International Union Against Cancer
- UICC).
Em 2004, o Brasil registrou 141 mil óbitos por câncer. As principais causas de morte por câncer no sexo masculino foram de pulmão, próstata e estômago, enquanto no sexo feminino foram de mama, pulmão e intestino.
A explicação desse percentual tão alto de óbitos por câncer está diretamente relacionada à maior exposição dos indivíduos a fatores de risco cancerígenos. Os atuais padrões de vida adotados em relação ao trabalho, nutrição e consumo em geral expõem os indivíduos a fatores ambientais mais agressivos, relacionados a agentes químicos, físicos e biológicos resultantes de um processo de industrialização cada vez mais evoluído.
Esta distribuição do processo de industrialização varia de intensidade em função das desigualdades sociais. Esses modelos de vida têm reflexos importantes no perfil epidemiológico das populações.
A redução das taxas de mortalidade e de natalidade indica o prolongamento da expectativa de vida e o envelhecimento populacional, levando ao aumento da incidência de doenças crônico-degenerativas, especialmente as cardiovasculares e o câncer. Com o recente envelhecimento da população, que projeta o crescimento exponencial de idosos, é possível identificar um aumento expressivo na prevalência do câncer, o que demanda, dos gestores do Sistema Único de Saúde (SUS), imenso esforço para a oferta de atenção adequada aos doentes.
O câncer constitui, assim, problema de saúde pública para o mundo desenvolvido e também para nações em desenvolvimento. No Brasil, a distribuição dos diferentes tipos de câncer sugere uma transição epidemiológica em andamento.
No Brasil, a estimativa, para o ano de 2008, das taxas brutas de incidência por 1 milhão e de número de casos novos por câncer em homens e mulheres, segundo a região e a análise por macrorregião, mostra que a Região Sudeste ocupa a primeira posição, responsável por 242.060 novos casos. A Região Sul encontra-se na segunda posição, com 99.580 novos casos; a Região Nordeste tem a terceira colocação, com 78.960 casos novos; a Região CentroOeste apresenta o quarto lugar, com 28.510 novos casos; e a Região Norte ocupa o quinto lugar, apresentando 17.620 casos novos.
Já dissemos aqui que os refrigerantes são altamente nocivos à saúde, porque tem PH de 2,5. Segundo o Dr. Lair Ribeiro, e segundo o filme que demonstrou, as águas tem em geral PH inferior a 6 e os refrigerante tem PH de 2,5. Observe na ilustração acima que a COCA -COLA é o alimento que tem o PH mais ácido da escala acima.
pH é o símbolo para a grandeza físico-química potencial hidrogeniônico (português brasileiro) ou potencial de hidrogénio (português europeu), que indica a acidez, neutralidade ou alcalinidade de uma solução aquosa.
O termo pH foi introduzido, em 1909, pelo bioquímico dinamarquês Søren Peter Lauritz Sørensen (1868-1939) com o objetivo de facilitar seus trabalhos no controle de qualidade de cervejas (à época trabalhava no Laboratório Carlsberg, da cervejaria homônima). O "p" vem do alemão potenz, que significa poder de concentração, e o "H" é para o íon de hidrogênio (H+).
Às vezes é referido do latim pondus hydrogenii.
Matematicamente, o "p" equivale ao simétrico do logaritmo (cologaritmo) de base 10 da atividade dos íons a que se refere. Para íons H+:Sendo querepresenta a actividade em mol dm-3.
Em soluções diluídas (abaixo de 0,1 mol dm-3), os valores da atividade se aproximam dos valores da concentração, permitindo que a equação anterior seja escrito como abaixo:
Medida de pHO pH pode ser determinado usando um medidor de pH (também conhecido como pHmetro) que consiste em um eletrodo acoplado a um potenciômetro.
O medidor de pH é um milivoltímetro com uma escala que converte o valor de potencial do eletrodo em unidades de pH. Este tipo deelétrodo é conhecido como eletrodo de vidro, que na verdade, é um eletrodo do tipo "íon seletivo".
O pH pode ser determinado indiretamente pela adição de um indicador de pH na solução em análise. A cor do indicador varia conforme o pH da solução. Indicadores comuns são a fenolftaleína, o alaranjado de metila e o azul de bromofenol.
Outro indicador de pH muito usado em laboratórios é o chamado papel de tornassol (papel de filtro impregnado com tornassol). Este indicador apresenta uma ampla faixa de viragem, servindo para indicar se uma solução é nitidamente ácida (quando ele fica vermelho) ou nitidamente básica (quando ele fica azul).
Obs.: Embora o valor do pH compreenda uma faixa de 0 a 14 unidades, estes não são os limites para o pH. São possíveis valores de pH acima e abaixo desta faixa, como, por exemplo, uma solução que fornece pH = -1,00, apresenta matematicamente -log [H+] = -1,00, ou seja, [H+] = 10 mol L-1. Este é um valor de concentração facilmente obtido em uma solução concentrada de um ácido forte, como o HCl.
um | células cancerosas têm um gradiente de pH invertida em comparação com as células normais adultas diferenciadas, incluindo um pH superior constitutivamente intracelular (pH i ) e um menor pH extracelular (pH e ), o que facilita os comportamentos adaptativos indicados.
b | A expressão aumentada e actividade de transportadores de membrana do plasma, em particular ácidos, extrusoras e anidrase carbónica (CAs) manter o pH superior i e pH mais baixo ede células tumorais.
MCT transportador, monocarboxilato; NHE1, Na + -H + permutador 1.
Magnitude do câncer no Brasil
A incidência do câncer cresce no Brasil, como em todo o mundo, num ritmo que acompanha o envelhecimento populacional decorrente do aumento da expectativa de vida. É o resultado direto das grandes transformações globais das últimas décadas, que alteraram a situação de saúde dos povos pela urbanização acelerada, dos novos modos de vida e novos padrões de consumo.A estimativa para 2006 previa uma ocorrência de 472 mil casos novos de câncer no Brasil (ou 355 mil, se excluídos os casos de tumores de pele não-melanoma), o que corresponde a quase dois casos novos por ano para cada 1.000 habitantes. Os cânceres mais incidentes, à exceção do de pele não-melanoma, são os de próstata, pulmão e estômago no sexo masculino; mama, colo do útero e intestino no sexo feminino.Quanto à mortalidade, em 2004, o Brasil registrou 141 mil óbitos. Câncer de pulmão, próstata e estômago foram as principais causas de morte por câncer em homens; mama, pulmão e intestino, as principais na mortalidade feminina por câncer.
Desvendando os Segredos do Câncer. pH
Tratamento do câncer acidificando o pH intracelular e alcalinizando o pH intersticial. As duas faces de Judas.
Dr. José de Felipe Junior
novembro/2008
- “Na arte de curar, deixar de aprender é omitir socorro e retardar tratamentos esperando maiores evidências científicas é ser cientista e não médico” JFJ
- “Em primeiro lugar sempre a Medicina Convencional,” JFJ
- “Se a Medicina Convencional não proporcionou os efeitos desejados temos o direito e o dever como médicos de utilizar os recursos da Medicina Complementar." JFJ
- “Nunca devemos trocar uma Medicina pela Outra, porém temos o dever de complementá-la com as Estratégias mais modernas da literatura médica de bom nível disponível” JFJ
- “Na verdade a MEDICINA é uma só” Vários Autores
- “É do médico a responsabilidade do paciente” Convenção de Helsinque
- “As enfermidades são muito antigas e nada a respeito delas mudou. Somos nós que mudamos ao aprender a reconhecer nelas o que antes não percebíamos” Charcot
- “A verdadeira causa das doenças e a MEDICINA ainda não fizeram as pazes. É porque a MEDICINA ainda é muito jovem. E o que dizer dos tratamentos” JFJ
 |
| IONS H+ |
Os íons H+ ou mais precisamente H3O+ são de importância fundamental na fisiologia e bioquímica da célula. Os íons H+ possuem a propriedade de construir pontes de hidrogênio entre as moléculas de água produzindo o que chamamos de água estruturada ou água tipo B : baixa densidade, inativa osmoticamente e viscosa. É a água predominante no citoplasma das células quiescentes , que não estão em regime de proliferação (Wiggins-1972).
 |
| KOSMOTROPO |
Pelo fato de funcionar como agente que estrutura a água os íons H+ são chamados de kosmotropos e comparando com outros agentes que constroem as pontes de hidrogênio o H+ é considerado um kosmotropo forte. Nas células neoplásicas predomina a água de alta densidade, ativa osmoticamente e fluída, com escassas pontes de hidrogênio e que chamamos de água desestruturada ou água tipo A. Os íons hidroxila OH- são agentes que destroem as pontes de hidrogênio e são chamados de íons caotropos sendo considerados agentes desestruturadores ou caotropos fortes.
O citoplasma de todas as células contém dois tipos de água : tipo A e tipo B. Nas células normais predomina a água tipo B e nas células neoplásicas a água tipo A. No citoplasma das células normais o pH é ácido, água estruturada e nas células neoplásicas o pH é alcalino, água desestruturada (Felippe-2008).
 |
| CITOPLASMA DA CÉLULA |
O presente trabalho é uma revisão dos fatores químicos que interferem na concentração de H+ no citoplasma das células neoplásicas, assim como as vias e mecanismos que foram descobertos recentemente. Este conhecimento nos permitirá entender melhor as estratégias que utilizaremos em clínica nos pacientes acometidos com a doença chamada câncer.
O pH do sangue normal está entre 7.38 e 7.42. No extracelular de células em estado quiescente, isto é sem proliferação o pH também está entre 7.38 e 7.42 , entretanto nas células em proliferação o extracelular é muito ácido, em geral com pH de 6.9 a 7.0, encontrando-se valores de até 6.0.
O pH intracelular de células normais gira em torno de 7.2 e das células em proliferação o pH é francamente alcalino.
 |
| GLICOSE ANAERÓBICA |
A maior fonte de ácidos é a respiração celular, onde a glicólise anaeróbia gera ácido lático e a fosforilação oxidativa gera CO2 que no meio aquoso forma ácido carbônico. Na célula normal o acido lático segue a via da fosforilação oxidativa mitocondrial e temos a formação de CO2 que acidifica levemente o citoplasma. A leve acidificação estrutura a água intracelular e as pontes de hidrogênio construídas permitem a função das enzimas e das macromoléculas ; mantém a estrutura terciária e quaternária das proteínas e mantém em posição as hélices do RNA e do DNA. Entretanto, quando acontece um excesso de acidificação a função celular é impedida. Neste momento com a finalidade de sobreviver entram em ação as bombas de extrusão de H+ , como o antiporter NHE1.
 |
| antiporter NHE1 |
Quando as células vão iniciar o processo de proliferação celular seja de uma forma fisiológica na reposição de células, seja na proliferação celular neoplásica, caracteristicamente o pH citoplasmático torna-se alcalino.
O primeiro trabalho da literatura que implicou o pH citoplasmático na mitose foi escrito por Johnson e Epel em 1976: “O pH intracelular do embrião do ouriço do mar aumenta 0.3 unidades de pH entre 1 e 4 minutos após a fertilização. O aumento do pH é requerido para o desenvolvimento inicial. O aumento resulta da troca de Na+ extracelular por H+ intracelular”. O aumento de 0.3 u de pH intracelular significa 30 nanomoles a mais de íons alcalinos OH- no citoplasma.
O início da proliferação celular por indução da mitose quase sempre é precedido pela alcalinização do citoplasma usualmente desencadeada pela estimulação dos canais de Na+ / H+ (Tannock -1989).
 |
| ANGIOGÊNESE TUMORAL |
Hoje sabemos que as células neoplásicas em proliferação tipicamente apresentam no intracelular alcalose metabólica com pH alcalino e no meio intersticial que a circunda, acidose metabólica com pH ácido. O pH alcalino intracelular promove as condições ideais de proliferação mitótica e o pH ácido intersticial condições ideais de proliferação, invasividade tumoral e metástases ao lado de inibir as células “natural killer” e os linfócitos T citotóxicos de defesa e promover a angiogênese.
 |
| MACRÓFAGOS |
ativando os macrófagos (Crowther-2001 , Vermeeulen-2004 , Felippe -2008).Geralmente o pH extracelular dos tumores é cerca de 0.5 unidades de pH mais ácido que o tecido não neoplásico correspondente; isto significa um aumento de 50 nanomoles de H+ no interstício tumoral (Yamagata-1996).
Em citologia, chamam-se macrófagos às células de grandes dimensões do tecido conjuntivo, ricos em lisossomas, que fagocitam elementos estranhos ao corpo. Os macrófagos derivam dos monócitos do sangue e de células conjuntivas ou endoteliais. Intervêm na defesa do organismo contra infecções. Também são ativos no processo de involução fisiológica de alguns órgãos. É o caso do útero, que, após o parto, sofre uma redução de volume, havendo uma notável participação dos macrófagos nesse processo.
Têm característica afinidade de cooperação com os linfócitos T e B.[1]Possuem duas grandes funções na resposta imunitárias: fagocitose e destruição do microrganismo; e apresentação de antigénios.
Expressam numerosos receptores:
- para citocinas pró-inflamatórias;
- para moléculas da parede bacteriana;
- para proteínas do complemento;
- para imunoglobulinas;
- para moléculas de adesão.
O pH ácido intersticial diminui a inibição por contato e facilita a proliferação celular ao lado de inibir as matrix metaloproteinases do interstício (MMPs) e promover a invasividade tumoral e o desgarramento das células, metástases.
 |
| MATRIX METALOPROTEINASES |
Vários autores verificaram que o pH na zona alcalina quero dizer a alcalose metabólica intracelular é elemento chave na indução da transformação neoplásica e ou na manutenção do processo neoplásico (Harguindey-1995 , Perona-1988 , Reshkin-2000).
Quando o pH intracelular se desloca para a zona alcalina invariavelmente acontecem os seguintes eventos:
ativação da fosfofrutokinase
aumento da glicólise anaeróbia, que é o motor da proliferação mitótica, pois fornece ATP para o núcleo
inibição da fosforilação oxidativa e do ciclo de Krebs
- aumento da síntese de DNA, ativando a glicose 6 fosfatodehidrogenase e o shunt das pentoses, evento precoce da mitose
- ativação do ciclo celular: fase S e fase G2/M
- diminuição da apoptose
- facilitação da transformação maligna
- aumento da proliferação celular neoplásica
- aumento da expressão de oncogenes
- aumento da atividade de fatores de crescimento
- aumento da invasividade tumoral
- aumento da migração celular: metástases
- aumento da angiogênese
- aumento da resistência à quimioterapia
- aumento da resistência á radioterapia
Se um fator externo provocar alcalinização citoplasmática em um grupo de células este aumento de íons OH- no citoplasma aumenta a água tipo A desestruturada a qual diminui o grau de ordem do sistema termodinâmico aberto que é a célula provocando um estado de aumento de entropia que em seu ponto máximo suportável atinge o “estado de quase morte”.
Neste instante as células para se manterem vivas ativam todos fatores de sobrevivência disponíveis desde a época que éramos seres unicelulares e para não morrer começam a proliferar. São células doentes lutando contra a morte, lutando contra o estado máximo de entropia.
 |
| ALCALINIZAÇÃO CITOPLASMÁTICA |
No cerne da alcalinização citoplasmática das células neoplásicas está a bomba Na+ / H+ uma estrutura de membrana que troca H+ intracelular por Na+ extracelular, alcalinizando o citoplasma e acidificando o interstício. É a bomba antiporter NHE1.
 |
| bomba antiporter NHE1 |
Nos mamíferos as NHE (existem 9 isoformas) se localizam na membrana celular e na membrana interna da mitocôndria. Além de interferir na concentração de H+ no intracelular elas regulam o volume celular e a reabsorção de NaCl nos rins, intestinos e outros epitélios.
Nas células normais com pH intracelular normal o NHE1 não é funcional e quando as células começam a produzir íons H+ e se acidifica este transportador é ativado. Nas células transformadas e nas células neoplásicas o NHE1 é hiperativo e a alcalinidade resultante está relacionada diretamente com a velocidade de proliferação celular descontrolada (Reshkin-2000 , Moolenar-1983 , Rich-2000).
A atividade da NHE1 também está relacionada com a invasão e a motilidade das células tumorais, devido à acidez intersticial (Reshkin-2000 , Klein-2000 , Denker-2002 , Putney-2003 , Lagana-2000 , Bourguignon-2004).
pH intracelular (pHi) e pH extracelular (pHe) dos tumores sólidos
Warburg em 1924 já havia mostrado “in vitro” que a glicólise tumoral depende fortemente dos níveis do pH.
Atualmente sabemos que as células neoplásicas apresentam o pH intracelular desviado para o alcalino, o pH extracelular desviado para o ácido e despolarização da membrana celular, isto é, diminuição do potencial trans-membrana ou baixo Em (Cone-1971 , Lang-1988, Marino-1994, Hagmat-1972, Bingelli-1980 , Sun-2003).
Nas situações que o paciente já recebeu vários tipos de quimioterápicos e está resistente a múltiplas drogas (“MDR”) invariavelmente encontram-se as alterações acima descritas (Keizer-1989 , Roepe-2001 , Hoffman-1996 , Perek-2002 , Weinsburg-1999).
Demonstrou-se que tanto nas células leucêmicas como nos tumores sólidos do endoderma, do mesoderma e do endoderma, encontra-se um pH alcalino no citoplasma. Em nenhuma outra moléstia humana encontra-se este tipo de anomalia.
Este gradiente de pH da célula cancerosa – alcalino dentro e ácido fora – parece ser uma característica fundamental de todas as células neoplásicas. Alguns autores acreditam que se encontrarmos métodos que acidifiquem o intracelular e alcalinizem o extracelular possivelmente estaremos resolvendo o problema que chamam câncer.
 |
| CÉLULAS NEOPLÁSICAS |
Este é um modo muito simplório de pensar, visto que como já demonstramos em estudos anteriores (Felippe- 2004 , 2005 , 2006, 2007, 2008) as células neoplásicas não podem ser consideradas como inimigas. Elas são células doentes tentando sobreviver e necessitam de tratamento e não de aniquilação. Entretanto, vamos continuar com esta revisão do câncer à luz do equilíbrio ácido – básico que se relaciona intimamente com a estruturação / desestruturação da água intracelular.
Na célula neoplásica predomina a glicólise anaeróbia que produz ácido lático. Para continuar proliferando a célula cancerosa além de ativar o antiporter Na+/H+ (saída de H+ e entrada de Na+) ativa também o simporter lactato / H+ (saída de lactato e saída de H+ do citoplasma): essas duas bombas alcalinizam o citoplasma e consequentemente ativam a fosfofrutokinae a qual ativa a glicólise anaeróbia e o shunt das pentoses (Wahl-2002 , Parkins-1997 , Yamagata-1998).
Entretanto existem outros sistemas de transporte que as células neoplásicas doentes colocam em ação com o objetivo de sobreviver.
Sistemas de transporte que provocam a alcalinização citoplasmática
Existem vários mecanismos de extrusão do H+, ao lado do NHE1:a- anidrases carbonicas b- vacuolar H+-ATPasesc- simporter H+/Cl-d- simporter lactato/H+e- bomba Na+/K+ ATPase (estimula a NHE1)f- antiporter Na+/H+ ou NHE1
Sabemos que a proliferação mitótica se faz em meio levemente alcalino e que o intenso metabolismo anaeróbio das células malignas com aumento exagerado da produção de ácido lático acidifica o meio intracelular e impede a proliferação celular. Como mecanismo de sobrevida as células malignas aumentam a expressão das anidrases carbônicas de membrana CAIX e CAXII, as quais transportam para o meio extracelular o excesso de íons H+ acidificando o interstício e alcalinizando o intracelular propiciando de um lado a invasividade tumoral e de outro alcançando um pH citoplasmático ideal para proliferação mitótica. A acetazolamida é um forte inibidor das anidrases carbônicas IX e XII (Felippe-2007).
 |
| ANIDRASE CARBONICA |
Para Ivanov as anidrases IX e XII se encontram somente nas células normais altamente especializadas. Entretanto, nas células transformadas acontece aumento da expressão destas enzimas como mecanismo de sobrevivência (Ivanov-2001). Para Zavadova a expressão da anidrase carbônica IX se restringe à mucosa do trato alimentar, porém, ela está presente em alta porcentagem de cânceres humanos, tecidos que normalmente não é encontrada (Zavadova-2005).
Nestes tecidos ela é induzida pela acidose intracelular e a hipoxia.
O principal responsável pela alcalinização citoplasmática continua sendo a bomba antiporter Na+/H+ ,entretanto precisamos lembrar que no melanoma esta bomba não é o principal fator responsável pelo desequilíbrio do pH.
É interessante assinalar que vários agentes carcinogênicos são capazes de ativar a bomba NHE1, provocando alcalose intracelular, acidose intersticial e despolarização de membrana celular: 1- forbol ester2- diacil-glicerol3- P-glicoproteína4- Tirosina-kinase5- Proteína kinase C6- TGF-alfa7- IGF-II 8- vários fatores de crescimento: EGF, PDGF, etc...9- oncogenes10- vanadato11- flúor12- cloreto de alumínio (AlCl3)13- várias drogas e agentes químicos considerados carcinogênicos
Os seguintes fatores são capazes de ativar o antiporter NHE1 provocando neoangiogênese:
IL-8
EGF
PDGF
G-CSF
GM-CSF
TNF-alfa
HGF/SF
TGF-alfa
IGF-I
PGE2 induz alcalose intracelular independente do NHE1
 |
| Resistência à insulina |
Por outro caminho a PTK promove a hidrólise do fosfatidilinositol-bifosfato produzindo diacil-glicerol e inositol trifosfato (IP3). O diacil-glicerol estimula a proteína kinase C que estimula o antiporter NHE1 alcaliniza o citoplasma e no final aumenta a síntese de DNA . O IP3 mobiliza cálcio das reservas do intracelular que ativa a G-6PD (Moolenaar-1985 e1986).
Sparks mostrou pela primeira vez na literatura que nas células transformadas a ativação da Na+/K+ ATPase induz um ciclo vicioso de ativação da NHE1 (Sparks-1983).
 |
| NHE1 |
Vários estudos têm mostrado categoricamente que a alcalinização citoplasmática com alcalose metabólica intracelular é fator essencial na transformação tumoral, desenvolvimento tumoral, crescimento celular, sobrevivência neoplásica e produção de metástases (DiGiammarino-2000 , Cameron-1984 , Orive-2003 , Reshkin-2000 , Moolenar-1983 , Rich-2000).
Em resumo podemos escrever que as evidências experimentais mostram que : todos fatores de crescimento potencialmente induzem a ativação do NHE1, na ausência de fatores de crescimento a proliferação celular pode ser induzida pela alcalinização citoplasmática, a resposta proliferativa é dependente de sódio extracelular, inibidores específicos da NHE1 bloqueiam a resposta proliferativa induzida pelos fatores de crescimento, e células que não possuem NHE1 apresentam divisão celular de baixa velocidade.
O outro lado da face de Judas :
o lado bom
Várias drogas funcionam inibindo o NHE1. Elas acidificam o intracelular e provocam diversos efeitos anticarcinogênicos tais como, diminuição da proliferação celular, indução da apoptose, inibição da angiogênese e diminuição da invasividade tumoral e das metástases:
Squalamina: diminui a proliferação celular e a angiogênese (Moore-1993)
Sulindac: induz apoptose e diminui a angiogênese tumoral
Genisteína: inibe a tirosina kinase, a proteína tirosino kinase, a proliferação das células endoteliais, a migraçãocelular, a trancetolase e a G-6PD do shunt das pentoses e inibe a ativação do plasminogênio-urokinase (Felippe-2006)
Captopril: diminui a angiogênese (Vogt-1997 , Volpert-1996 , Adachi-1999)
Amiloride: diminui a atividade do plasminogênio-urokinase
Edelfosine: diminui a angiogênese
Edelfosina (ET-18-O-CH3, 1-octadecil-2- O -metil-glicero-3-fosfocolina) [ 1 ] é uma síntese de alquil-lisofosfolípido (ALP). Tem antineoplásico (anti-câncer) efeitos. [ 2 ]Como todas as ALP, incorpora na membrana da célula alvo e não o ADN . Em muitas células tumorais, causa selectiva de apoptose , poupando as células saudáveis. [ 3 ] edelfosina pode ativar o Fas / CD95 receptor de morte celular, [ 4 ] pode inibir a MAPK / ERK via mitogénica e a Akt / proteína quinase B (PKB) sobrevivência caminho. [ 3 ] [ 5 ] Além desses efeitos de plasma de nível, edelfosina também afeta a expressão gênica por modulando a expressão e atividade de fatores de transcrição. [ 3 ] [ 4 ]Tem propriedades moduladoras do sistema imunológico. [ 6 ] Estas características edelfosina causar também a afectar o HIV , [ 7 ] parasitária, [ 4 ] [ 8 ] e de doenças auto-imunes. [ 4 ] [ 9 ]Pode complementar clássicos fármacos anti-cancro, tais como a cisplatina . [ 10 ]Ela pode ser administrada por via oral, por via intraperitoneal (IP) ou intravenosa (IV).Edelfosina ALPs e outros podem ser utilizados para a purga de células leucémicas residuais a partir de medula óssea, os transplantes. [ 4 ] [ 11 ] [ 12 ]É um análogo de miltefosina e perifosine .
Somatostatina: aumenta Bax e p53 e provoca apoptose (Thangaraju-1999)
 |
| A somatostatina é um hormônio protéico produzido pelas células delta do pâncreas, em lugares denominados Ilhotas de Langerhans. Intervém indiretamente na regulagem da glicemia, e modula a secreção da insulina e glucagon. A secreção da somatostatina é regulada pelos altos níveis de glicose, aminoácidos e de glucagon. Seu déficit ou seu excesso provocam indiretamente transtornos no metabolismo dos carboidratos. |
Progesterona , mas não a 20 alfa Hidroxiprogesterona (Chien-2007)
Clonidine
Harmaline
A somatostatina inibe o NHE1 e a bomba H+-ATPase provocando acidificação intracelular e induzindo a p53 e o Bax que são fatores apoptóticos. A somatostatina também inibe a glicose-6-fosfatodehidrogenase e a transcetolase e assim dificulta a produção de DNA no shunt das pentoses.
A progesterona natural , mas não a 20 alfa hidroxiprogesterona provoca inibição não genômica da bomba NHE1, acidifica o citoplasma e suprime a resposta celular a mitógenos. A progesterona natural é um imunomodulador que suprime a ativação das células T durante a gestação. Este é o primeiro trabalho da literatura mostrando que a progesterona inibe o antiporter NHE1 (Chien-2007).
Outras drogas acidificam o intracelular por mecanismo diferente da inibição da NHE1 e provocam o mesmo tipo de efeitos anticarcinogênicos :
Warfarin: diminui a síntese de prostaglandinas , acidifica o citoplasma e diminui a angiogênese tumoral
Suramin: inibe a H+-ATPase e diminui a angiogênese e a proliferação tumoral
Staurosporina: induz acidificação intracelular por mecanismo desconhecido e diminui a angiogênese
Lovastatina: induz acidificação intracelular e provoca apoptose (Pérez-Sala-1995)
A lovastatina diminui a isoprenilação das proteínas, acidifica o citoplasma, aumenta a degradação do DNA e provoca finalmente a apoptose celular. O pH citoplasmático chega a decrescer 0.9 unidades (aumento de 90 nanomoles de H+) e o efeito é dose dependente, isto é, quanto maior a dose de lovastatina maior a indução de apoptose.
A apoptose promovida pela lovastatina é inibida pela suplementação com mevalonato, pela ativação da proteína kinase C e pela inibição da síntese protéica fatores estes que promovem a alcalinização do meio intracelular (Pérez-Sala-1995).
Já vimos que a acidificação do intracelular por ex., inibindo o antiporter NHE1, abole uma série de fatores de crescimento, aumenta a apoptose e induz a parada do ciclo celular mitótico (Rotin-1987 , Vairo-1992 , Doppler-1985 , Boscoboinik-1989 , Sanchez-Perez-1995).
Do lado oposto a alcalinização do intracelular por ex., por drogas que ativam o antiporter NHE1 facilita a ação dos fatores de crescimento, diminui a apoptose e acelera o ciclo celular e assim induzem o insucesso do tratamento do câncer, sendo portanto formalmente contra-indicadas (DiGiammarino-2000 ,Gillies-1990 ,Terradez-1993):
imidazol
cloroquina
glutationa
mevalonato
fatores que ativam a proteína kinase C
Muitas substâncias capazes de induzir apoptose nas células neoplásicas são capazes também de provocar acidificação intracelular (Park-1999 , Wolf-1997 , Overbeeke-1999 , Angoli-1996 , Furlong-1997 , Matsuyama-2000 , Rebollo-1995 , Li-1995 , Luo-1994 , Hamilton-1993 , Zanke-1998 , Shrode-1997 , Gottlieb-1995 , Roepe-1993 , Garcia Canero-1999 , Tannock-1989 , Murakami-2001 , Goossens-2000 , Barry-1993 , Altan-1998).
Lembrar que acidificação intracelular significa aumento da água tipo B , estruturada, fisiológica com caráter entrópico negativo e alta ordem no sistema termodinâmico celular.
A resistência dos tumores às drogas pode ser devida à sua falência em provocar a devida acidificação da célula neoplásica (Torigoe-2002 , Belhoussine-1999).
De fato, drogas usadas na quimioterapia como a adriamicina, cisplatina, paclitaxel e camptotecin são incapazes de provocar apoptose quando o citoplasma não está acidificado (Keizer-1989 , Reshkin-2003 , Murakami-2001, Goossens-2000 , Mayer-1986).
Algumas drogas ativam o NHE1 , alcalinizam o citoplasma, porém não induzem a proliferação celular. O motivo é que tais efeitos são de pouca intensidade e principalmente de curta duração.
catecolaminas
bradicinina
cafeína
teína
fatores quimiotáticos
caeruleina
ferricianide
ácido retinóico
Acidose intracelular por inibição da extrusão do ácido lático pelos bioflavonoides
Os bioflavonoides são potentes inibidores da extrusão de ácido lático nas células do tumor de Ehrlich. Os bioflavonoides mais potentes são aqueles que possuem 4 a 5 grupos hidroxila. A quercetina é capaz de inibir até 50% do efluxo de lactato na dose de 0,1 microgramos, in vitro. Nota-se também diminuição parcial da produção de lactato. Este efeito é secundário à acidificação das enzimas glicolíticas, principalmente da fosfofrutokinase que necessita de um pH alcalino ideal para o integral funcionamento (Belt-1979).
Alguns bioflavonoides inibem a glicólise anaeróbia de uma grande variedade de tumores interferindo no ADP e no fosfato inorgânico que são requeridos na glicólise. Os bioflavonoides e principalmente a quercetina inibem também a bomba Na+/K+ - ATPase.
A quercetina inibe a proliferação de vários tipos de células tumorais em cultura em doses muito pequenas, da ordem de 5 a 20 microgramos por ml de meio de cultura (Soulinna-1975).
O problema em clínica é que a quercetina é pobremente absorvida pelo trato gastrointestinal, o que levou Helion Povoa a sugerir o seu uso por via sub-lingual.
Acidose Metabólica no Câncer
Conhecemos muitos relatos na literatura de regressão espontânea do câncer relacionadas com a acidificação do organismo tanto em animais como em seres humanos.
O primeiro trabalho da literatura mostrando os efeitos curativos da acidose no câncer talvez tenha sido escrito por Ana Goldfeder onde relatou “o tratamento acidótico das neoplasias” (Goldfeder-1933).
Em 1931 Meyer associou a indução de acidose metabólica local ou sistêmica com as regressões do câncer observadas com as toxinas do soro de Coley e outros processos que provocavam febre (Mayer-1931, Reding-1928 e 1929 - in Harguindey-2005).
Anghlieri usando o cloreto de amônio , Selawry o ácido lático Harguindey o ácido clorídrico e Verne e Mori o ácido acético, repetidamente observaram regressões completas de vários tipos de tumores implantados em animais. Entretanto, os estudos em animais são de curto prazo e os autores não mostram as estatísticas de sobrevivência. A acidose metabólica prolongada e acentuada aumenta o índice de caquexia e provoca arritmias ventriculares inclusive a parada cardíaca.
Existem relatos de muitas regressões tumorais em pacientes submetidos a uretero-sigmoidostomia, procedimento que provoca acidose metabólica importante (Mahoney-1960 , Harguindey-1975).
Gatenby em 2002 considerou a azotemia com moderada acidose metabólica a responsável pelo aumento de sobrevida e redução das metástases nos pacientes com câncer que se submeteram a nefrectomias.
A moderada acidose metabólica proporciona estruturação da água citoplasmática e provoca a regressão do tumor com aumento da sobrevida, porque atingimos o cerne da fisiopatogenia do câncer, que é o estado de quase morte provocado pelo grave aumento da entropia celular ( Felippe-2008).
Entretanto, se a acidose for intensa e de longa duração ela facilita a invasividade tumoral e as metástases por ativar as metaloproteinases da matrix extracelular (MMPs) assim como impede a ação do sistema de defesa do hospedeiro inibindo os linfócitos T citotóxicos e as células “natural killer”.
Cruelmente a acidose intersticial peri-tumoral ativa os macrófagos os quais aumentam a produção de fatores que promovem a neo-angiogênese tumoral (Crowther-2001 , Vermeeulen-2004). Quando o pH se reduz no interstício acontece inibição da quimiotaxia, da capacidade bactericida e da atividade respiratória dos polimorfonuclear leucócitos ao lado da diminuição da citotoxicidade e da proliferação dos linfócitos T (Lardner-2001).
Quando um típico fibroblasto humano diplóide cresce em meio com tampão bicarbonato com pH variando de 6.9 a 8.0 o crescimento é limitado por um mecanismo chamado inibição por contato. Este fato independe do tipo de tampão, o crucial é o nível do pH do meio que circunda a célula. Quando o meio é ácido ocorre diminuição da inibição por contato e a proliferação é maior. Tudo indica que a inibição do crescimento por contato é fortemente dependente do pH.
Existem algumas diferenças importantes assim como muitas semelhanças entre as células normais e as células neoplásicas. As células neoplásicas crescem muito bem em pH ácido e portanto são menos susceptíveis à inibição por contato, entretanto quando bicarbonato é colocado no meio as células cancerosas sofrem um declínio no crescimento (Ceccarini-1971).
O pH ácido intersticial diminui a inibição por contato e facilita a proliferação celular. Pelo contrário, o pH alcalino aumenta a inibição por contato e dificulta o crescimento celular diminuindo a proliferação celular.
 |
| Médico Italiano Tulio Simoncini |
 |
| REGRESSÃO TUMORAL PELA APLICAÇÃO DE BICABORNATO DE SÓDIO |
Casos clínicos do Dr Tullio Simoncini nas suas palavras:
Case one: A patient diagnosed with pulmonary neoplasm of
Caso um: Um paciente diagnosticado com cancer pulmonar
the lung, underwent treatment with sodium bicarbonate,
foi tratado com Bicabornato de sódio
before submitting to surgery to remove part of the lung.
depois de diagnóstico sugerido de remoção de parte do pulmão.
Treatment consisted of sodium bicarbonate administered
O tratamento consistiu de adminstração de Bicabornato de sódio
orally, by aerosol, and IV. After first treatment reduction of
de forma oral por inalação. Depois da primeira fase do tratamento a redução dos nódulos demosnstrou-se evidente
nodules and absorption was evident, and after 8 months
Após 8 meses não eram mais nenhum desses nódulos visíveis.
was no longer visible at all. Treatments also reduced size of
O tratamento reduziu o tamanho dos nodulos e foi confirmado por Raios X e Tomografia computadorizada.
the liver and results were confirmed by both X-ray and CAT scan.
Caso um: Um paciente diagnosticado com cancer pulmonar
the lung, underwent treatment with sodium bicarbonate,
foi tratado com Bicabornato de sódio
before submitting to surgery to remove part of the lung.
depois de diagnóstico sugerido de remoção de parte do pulmão.
Treatment consisted of sodium bicarbonate administered
O tratamento consistiu de adminstração de Bicabornato de sódio
orally, by aerosol, and IV. After first treatment reduction of
de forma oral por inalação. Depois da primeira fase do tratamento a redução dos nódulos demosnstrou-se evidente
nodules and absorption was evident, and after 8 months
Após 8 meses não eram mais nenhum desses nódulos visíveis.
was no longer visible at all. Treatments also reduced size of
O tratamento reduziu o tamanho dos nodulos e foi confirmado por Raios X e Tomografia computadorizada.
the liver and results were confirmed by both X-ray and CAT scan.
Case two: A nine-year-old child is hospitalized and
Caso dois: Uma criança com nove anos de idade é hospitalizada e
diagnosed with Ewing’s Sarcoma on the right humerus.
diagnosticada com sarcoma de EWING no humero direito.
Despite several chemotherapy cycles surgery removed the
Depois de ciclos intensos de quimioterapia foi sugerido a remoção do osso afetado.
humeral bone. Growth of three tumor masses continued
Apesar da continuação de ramificações tumorais existentes
despite continued efforts to stop progression. Sodium
o que resultaria na continuação do tratamento quimioterápico.
bicarbonate salts treatment were then started administered
Passamos a administrar Bicabornato de sódio por meio de um cateter em sua artéria sob a clavícula direita
by catheter into the right sub-clavian artery in order to administer the salts (phleboclysis of 500 cc at five per cent)
Administramos esses sais diluidos (phleboclysis de 500 cc a cinco por cento)...
directly on the tumoral masses. Of the 3 masses shown by
...diretamente na massa tumoral. Das tres massas mostradas pela tomografia em 7 de maio de 2001, os tamanhos eram respectivamente de 6,5 cm, 4,4 cm e 2,4 cm.
the scographic scan of May 7, 2001, whose size is respectively:a. 6,5 cmb. 4,4 cmc. 2,4 cm After the sodium
Após a administração de Bicabornato de sódio, os tumores reduziram-se significativamente diminuindo para um tamanho de apenas 1,5 cm, vindo depois a cicatrizarem-se como resultado do tratamento como mostrado pelo ecografo em 10 de setembro de 2001.
bicarbonate salts treatment only one tumor was left, with a size of only 1.5 cm, which is most likely residual scarring, as shown by the echography of September 10, 2001.
Caso dois: Uma criança com nove anos de idade é hospitalizada e
diagnosed with Ewing’s Sarcoma on the right humerus.
diagnosticada com sarcoma de EWING no humero direito.
Despite several chemotherapy cycles surgery removed the
Depois de ciclos intensos de quimioterapia foi sugerido a remoção do osso afetado.
humeral bone. Growth of three tumor masses continued
Apesar da continuação de ramificações tumorais existentes
despite continued efforts to stop progression. Sodium
o que resultaria na continuação do tratamento quimioterápico.
bicarbonate salts treatment were then started administered
Passamos a administrar Bicabornato de sódio por meio de um cateter em sua artéria sob a clavícula direita
by catheter into the right sub-clavian artery in order to administer the salts (phleboclysis of 500 cc at five per cent)
Administramos esses sais diluidos (phleboclysis de 500 cc a cinco por cento)...
directly on the tumoral masses. Of the 3 masses shown by
...diretamente na massa tumoral. Das tres massas mostradas pela tomografia em 7 de maio de 2001, os tamanhos eram respectivamente de 6,5 cm, 4,4 cm e 2,4 cm.
the scographic scan of May 7, 2001, whose size is respectively:a. 6,5 cmb. 4,4 cmc. 2,4 cm After the sodium
Após a administração de Bicabornato de sódio, os tumores reduziram-se significativamente diminuindo para um tamanho de apenas 1,5 cm, vindo depois a cicatrizarem-se como resultado do tratamento como mostrado pelo ecografo em 10 de setembro de 2001.
bicarbonate salts treatment only one tumor was left, with a size of only 1.5 cm, which is most likely residual scarring, as shown by the echography of September 10, 2001.
Case three: A 62-year-old patient undergoes surgery in
Caso três: Um paciente com 62 anos veio a dar entrada com caso sugerido de Adenocarcinoma endometrial dpoisde sucessivos ciclos de radioterapia e terapia anti hormônio.
December 1998 for endometrial adenocarcinoma, followed by successive cycles of radiotherapy and anti-hormone therapy.
Um espesso tumor no peritôneo desenvolvia-se caracterizando o Carcinoma. O paciente estava abatido e exaurido, apresentando inchaços generalizados, problemas intestinais diversos, irregularidade na evacuação, depressão, instabilidade emocional e pressão sanguínea instavel.
Following the thickening of the peritoneum and the growth of several lymph nodes due to carcinosis; from the clinical point of view, the patient’s condition decayed with the presence of exhaustion, general swelling, intestinal meteorism, irregularity of evacuation, steady feeling of heaviness and blood pressure instability.
Iniciamos o tratamento com uma solução de 5% de bicabornato de sódio administrado alternadamente por meio de um cateter via endoperitonial.
Treatment with a 5% sodium bicarbonate solution administered alternately thru an endoperitoneal catheter and via
Demonstrou-se uma rápida mudança para uma condição normal de saúde. No final uma tomografia computadorizada, confirmou a sua recuperação, e a regressão do carcinoma peritonial e a estabilização do nódulos, comparativamente ao ano precedente.
IV showed rapid improvement to a normal condition of health. A final CAT scan confirms the regression of the peritoneal carcinosis and a stabilization of the size of the lymph nodes when compared to the preceding year.
Caso três: Um paciente com 62 anos veio a dar entrada com caso sugerido de Adenocarcinoma endometrial dpoisde sucessivos ciclos de radioterapia e terapia anti hormônio.
December 1998 for endometrial adenocarcinoma, followed by successive cycles of radiotherapy and anti-hormone therapy.
Um espesso tumor no peritôneo desenvolvia-se caracterizando o Carcinoma. O paciente estava abatido e exaurido, apresentando inchaços generalizados, problemas intestinais diversos, irregularidade na evacuação, depressão, instabilidade emocional e pressão sanguínea instavel.
Following the thickening of the peritoneum and the growth of several lymph nodes due to carcinosis; from the clinical point of view, the patient’s condition decayed with the presence of exhaustion, general swelling, intestinal meteorism, irregularity of evacuation, steady feeling of heaviness and blood pressure instability.
Iniciamos o tratamento com uma solução de 5% de bicabornato de sódio administrado alternadamente por meio de um cateter via endoperitonial.
Treatment with a 5% sodium bicarbonate solution administered alternately thru an endoperitoneal catheter and via
Demonstrou-se uma rápida mudança para uma condição normal de saúde. No final uma tomografia computadorizada, confirmou a sua recuperação, e a regressão do carcinoma peritonial e a estabilização do nódulos, comparativamente ao ano precedente.
IV showed rapid improvement to a normal condition of health. A final CAT scan confirms the regression of the peritoneal carcinosis and a stabilization of the size of the lymph nodes when compared to the preceding year.
Caso quatro: Um paciente de 40 anos de idade, foi indicado para mastectomia radical esquerda por causa de um carcinoma mamário que vinha se desenvolvendo a sete meses.
Após tres meses de quimioterapia, o paciente viu-se afetado por metastases (tumores malignos) nos pulmões e na glândula hepatica. Ocorreu também tumores nos ossos, na quinta e sexta vértebra lombar com invasão e compressão do canal da medula, causando dor e sofrimento, causando a rejeição do paciente ao tratamento quimioterápico, e passando ao uso de drogas para controle da dor, inclusive morfina, mas tudo isso tornou-se ineficiente para o controle da dor, causando prostração e impossibilidade de dormir.
Começamos com injeções de Sais de bicabornato de sódio na região lombar. O Dr. Tulio Simoncini descreve, que pelo fato de ter administrado pequenas doses de 50 cc de solução de bicaboranto de sodio a 8,4%, o paciente confessou ter conseguido dormir apenas 2 horas na ultima semana, e que gostaria de dormir apenas meia hora naquela noite. No dia seguinte ele telefonou dizendo que conseguira dormir toda a noite. Após mais dois meses de injeções na região lombar com bicabornato de sódio, as dores despareceram completamente. As ressonancias magnéticas tomadas após o tratamento deixaram perplexos os médicos que ficaram chocados com o sucesso do tratamento.
Após tres meses de quimioterapia, o paciente viu-se afetado por metastases (tumores malignos) nos pulmões e na glândula hepatica. Ocorreu também tumores nos ossos, na quinta e sexta vértebra lombar com invasão e compressão do canal da medula, causando dor e sofrimento, causando a rejeição do paciente ao tratamento quimioterápico, e passando ao uso de drogas para controle da dor, inclusive morfina, mas tudo isso tornou-se ineficiente para o controle da dor, causando prostração e impossibilidade de dormir.
Começamos com injeções de Sais de bicabornato de sódio na região lombar. O Dr. Tulio Simoncini descreve, que pelo fato de ter administrado pequenas doses de 50 cc de solução de bicaboranto de sodio a 8,4%, o paciente confessou ter conseguido dormir apenas 2 horas na ultima semana, e que gostaria de dormir apenas meia hora naquela noite. No dia seguinte ele telefonou dizendo que conseguira dormir toda a noite. Após mais dois meses de injeções na região lombar com bicabornato de sódio, as dores despareceram completamente. As ressonancias magnéticas tomadas após o tratamento deixaram perplexos os médicos que ficaram chocados com o sucesso do tratamento.
Case four: A 40-year-old patient underwent surgical intervention (left radical mastectomy) for mammarian carcinoma seven months earlier. After three months of chemotherapy, the patient is affected by: “diffused pulmonary and hepatic metastasis; bone metastasis particularly to the fifth and sixth lumbar vertebrae, with invasion and compression of the medullar channel, which is causing extreme pain which makes the patient unresponsive to any treatment.” All pain suppressant drugs – morphine included – are totally ineffective and the patient is totally prostrate even unable to sleep. Sodium bicarbonate salts, lumbar injections are begun. Dr Tullio Simoncini recounts: “As I administer it by slowly injecting 50 cc of sodium bicarbonate solution at 8.4 %, the patient tosses and with a thread of a voice confesses to me that she has slept only two hours in the last week. Exhausted, she whispers to me: “If only I could sleep half an hour tonight.” But the day after, she calls me on the phone and says: “I have slept all night”. After two more lumbar injections of the bicarbonate salts in the next month, the pain disappeared completely. Magnetic Resonance imaging reports performed before and after treatment were defined by hospital head of the radiology department as “shocking”.
Considerações Finais
Autores sérios e sem conflito de interesse, isto é, aqueles que não recebem proventos da Indústria Farmacêutica afirmam que as drogas quimioterápicas geralmente estão desenhadas no velho conceito de “combater o DNA” . Assim sendo nos últimos 60 anos persiste o velho modo de tratar o câncer atacando o DNA e deste modo invariavelmente os tratamentos do câncer continuam a fracassar. (Gajate-2002 , Bhujwalla-2001 in Harguindey-2005).
Outros autores do mesmo grau de seriedade e independentes afirmam que os quimioterápicos são geralmente os responsáveis por exacerbar o fenótipo maligno por induzir a parada da apoptose e desta maneira facilitar a progressão do câncer (Torigoe-2002 , Rockwell-2001).
Os fatos acima são observados freqüentemente no consultório daqueles que praticam medicina interna. Os pacientes chegam sem apetite, com extremo cansaço, muita dor e a indicação dos especialistas em câncer nestes casos são os cuidados paliativos e o diagnóstico deles é brilhante: paciente “resistente a múltiplas drogas”, como se a responsabilidade por esse fato fosse do paciente. É o famoso paciente “MDR”.
Quando o organismo se contamina com metais tóxicos, aditivos alimentares, agrotóxicos, parabeno dos cosméticos, flúor do creme dental ou da água mineral do Supermercado, sofrem infecções virais, etc., a fisiologia celular de um grupo de células é prejudicada. Estes elementos estranhos ao organismo provocam inflamação crônica sub-clínica que lentamente diminui os osmolitos kosmotropos do intracelular e vagarosamente transformam a água B estruturada em água A desestruturada a qual gradativamente diminui o grau de ordem-informação do sistema termodinâmico deste grupo de células.
Ao atingir o ponto máximo suportável de entropia as células entram em um “estado de quase morte”. Neste ponto de baixa concentração de osmolitos citoplasmáticos, predomínio de água A e alta entropia as células se transformam e lutam para se manterem vivas e o único modo de sobreviver é através da proliferação.
Elas imediatamente colocam em ação mecanismos milenares de sobrevivência, justamente aqueles que nos mantiveram vivos no Planeta durante a Evolução. Desta forma ocorre ativação de fatores e vias de sinalização, ativação do NHE1 com alcalinização citoplasmática e ativação da glicólise anaeróbia, etc, os quais promovem a proliferação celular neoplásica, a diminuição da apoptose, a formação de novos vasos e o impedimento da diferenciação celular (Felippe fev. e maio de 2008).
Outros fatores que podem desencadear inflamação crônica sub-clínica e conseqüentemente transformação neoplásica são os campos eletromagnéticos provocados por cabos de alta tensão, torres de celular, transformadores, etc. Menos conhecidos dos médicos porem muito estudados são as zonas geopatôgenicas dos rios subterrâneos e da rede de Hartman. O oncologista Hans Niepper, ex presidente da Sociedade Alemão de Oncologia mostrou que 70% dos pacientes com câncer dormem ou trabalham em zona geopatogênica ( Felippe-2003-2004-2005-2006-2007-2008).
A quimioterapia e a radioterapia são fatores extras de aumento da entropia e diminuição da ordem das células neoplásicas e aquelas que não morrem saem mais fortalecidas, com os seus mecanismos de sobrevivência ainda mais aguçados. Este nicho de células sobreviventes é a razão das incontáveis falhas terapêuticas deste tipo arcaico de estratégia.
Devemos nos lembrar que a regressão do tumor não significa a cura do paciente. A doença não é simplesmente o tumor visível , a doença é do organismo todo, o qual deve ser tratado com todo respeito bioquímico, fisiológico, toxicológico, eletromagnético, psicológico e espiritual.
Temos que retirar do organismo metais tóxicos, aditivos alimentares, agrotóxicos , afastar o paciente de campos eletromagnéticos e de zonas geopatogênicas, ensinar uma alimentação da agricultura orgânica e ecológica com 70% dos alimentos crus para elevar o grau de ordem das células , cuidar do sono, orientar para orar, rezar e praticar meditação ao lado de colocar em bom funcionamento o sistema imunológico, digestivo e endócrino.
Conclusão
Nos aproximamos cada dia mais de um novo tempo em que, conhecendo o funcionamento das células normais na sua intimidade, podemos encarar o organismo de uma forma mais inteligente. E, se conhecemos a fisiologia de uma célula normal conseqüentemente sabemos, ou estamos muito perto de saber o que é uma célula dita cancerosa, dita maligna.
Quando éramos seres unicelulares lá nos tempos remotos da nossa existência conseguimos nos manter vivos graças aos mecanismos de sobrevivência adquiridos durante a nossa Evolução no Planeta.
As células neoplásicas nada mais são do que carne da nossa própria carne que, possuindo mecanismos idênticos aos que garantiram a nossa sobrevivência durante o processo de evolução, estão tão aptas quanto as células normais a sobreviver nas condições mais adversas possíveis.
Quando um grupo de células do nosso corpo começa a sofrer, algumas morrem; entretanto, a maioria coloca em ação os mecanismos de sobrevivência que adquirimos desde os tempos remotos. Não são células cancerosas ou malignas são células doentes lutando bravamente para se manterem vivas e o único modo que restou foi proliferar desesperadamente, desordenadamente.
Vamos cuidar das células neoplásicas fornecendo a elas o que necessitam para voltarem a conviver no ambiente social de um corpo saudável , da forma desejada.
Os elementos mais simples de conforto para as células é lhes proporcionar de início um pH ideal e uma osmolalidade ideal.
“Não vamos desistir desta luta”
“No mundo não há fracassados e sim desistentes” Confúcio
Referências bibliográficas
Adachi E., Tannock I.F., The effect of vasodilating drugs on pH of tumors, Oncol. Res. 11 179-185; 1999.
Altan N., Chen Y., Schindler M., Simon S.M., Defective acidification in human breast tumor cells and implications for chemotherapy, J. Exp. Med. 187 1593-1598; 1998.
Anghlieri L.J., Tumor growth inhibition by ammonium chloride induced acidosis, Int. J. Pharmacol. Biopharm. 12 320-326; 1975.
Angoli D., Delia D., Wanke E., Early cytoplasmatic acidification in retinamide-mediated apoptosis of human promyelocitic cells, Biochem. Biophys. Res. Commun. 229 681-685; 1996.
Barry M., Reynolds J.E.,Eastman A., Etoposide-induced apoptosis in human HL-60 cells is associated with intracellular acidification, Cancer Res. 53 2349-2357; 1993.
Becker Y. Anticancer role of dendritic cells (DC) in human and experimental cancers-a review. Anticancer Res 12: 511-520; 1992.
Belhoussine R., Morjani H., Sharonov S., Ploton D., Manfait M., Characterization of intracellular pH gradients in mutidrug-resistant tumor cells by means of scanning microspectrofluorimetry and dual-emission-ratio probes, Int. J. Cancer 81 81-89; 1999.
Belt JA; Thomas JA; Buchsbaum RN; Racker E. Inhibition of lactate transport and glycolysis in Ehrlich ascites tumor cells by bioflavonoids. Biochemistry; 18(16): 3506-11, 7 Aug 1979.
Bhujwalla Z.M., Artemov D., Abooagye E., Ackerstaff E., Gillies R.J., Natarajan K., Solaiyappan M., The physiological environ-ment in cancer vascularization, invasion and metastasis, in: R.J. Gillies (Ed), The Tumor Microenvironment: Causes and Consequences of Hypoxia and Acidity, Novartis Found. Symp., vol. 240, John Wiley and Sons, Chichester, NY, pp. 23-38; 2001.
Bingelli R., Cameron I.L., Cellular potentials of normal and cancerous fibroblasts and hepatocytes, Cancer Res. 40, 1830-1835; 1980
Boscoboinik D., Gupta R.S., Epand R.M., Altered intracellular pH and Na+/H+ antiport activity in multidrug resistance cell lines, Cancer Chem. Pharmacol. 24 s86; 1989.
Bourguignon L.Y., Singleton P.A., Diedrich F., Stern R., Gilad E., CD44 interaction with Na+ -H+ exchanger (NHEI) creates acidic microenvironments leading to hyaluronidase-2 and cathepsin B activation and breast tumor cell invasion, J. Biol. Chem. 279; 26991-27007; 2004.
Cameron I.L., Intervention of sodium flux as a target for cancer chemotherapy, New Approaches to Cancer Chemotherapy, Academic Press, New York, pp. 355-374; 1984.
Cañero R.G., Na+/H+ antiport, in: F.L. Crane, D.J. Morré, H. Löw (Eds.), Oxidoreduction at the Plasma Membrane: Relation to Growth and Transport, CRC Press, Boca Raton, pp. 237-246; 1990.
Cañero R.G., Trilla C., J. Diego J.P., Gil J.J.D., Cobo J.M., Na+: H+ exchange inhibition induces intracellular acidosis and differentially impairs cell growth and viability of human and rat hepatocarcinoma cells, Toxicol. Lett. 106 215-228; 1999.
Ceccarini C; Eagle H. Induction and reversal of contact inhibition of growth by pH modification. Nature New Biology vol 233 october 27 1971.
Chien EJ, Liao CF, Chang CP, Pu HF, Lu LM; Shie MC; Hsieh DJ; Hsu MT. The non-genomic effects on Na+/H+ -exchange 1 by progesterone and 20 alphahydroxyprogesterone in human T cells. J. Cell Physiol, 211(2): 544-50; May 2007.
Cone Jr C.D., Unified theory on the basic mechanism of normal control and oncogenesis, J. Theor. Biol. 30, 151-181; 1971.
Crowther M, Brown NJ, Bishop ET, Lewis CE. Microenvironmental influence on macrophage regulation and angiogenesis in wounds nad malignant tumors. J Leukoc Biol 70: 478-490; 2001.
Crowther M.; Brow N.J.; Bishop, ET; Lewis, CE. Microenvironmental influence on macrophage regulation of angiogenesis in wounds and malignant tumors. Biol. 70: 478-490; 2001.
Dadabayev AR, Sandel MH, Menon AG, Morreau H, Melief CJ, Offringa R, Van Der Burg SH, Rhijn CJ, Ensink NG, Tollenaar RA, Van De Velde CJ, Kuppen PJ. Dendritic cells in colorectal cancer correlate with other tumor-infiltrating immune cells. Cancer Immunol Immunother 53: 978-986; 2004.
Denker P., Barber D.L., Ion transport proteins anchor and regulate the cytoskeleton, Curr. Opin. Cell Biol. 14 214-220; 2002.
DiGiammarino J., Lee A.D.S., Cadwell C., Zhang W., Bothner B.; Ribeiro R.C, Zambetti G., Kriwacki R.W., A novel mechanism of tumorogenesis involving pH-dependent destabilization of a mutant p53 tetramer, Nat. Struct. Biol.(1) 12-16; 2000.
Doppler W., Maly K., Hofmann J., Grunicke H., Inhibition of tumor cell growth by interference with growth factor induced cell proliferation, in: T. Galeotti, A. Cittadini, G. Neri, S. Papa, L.A. Smets (Eds.), Cell Membranes and Cancer, Elsevier, Amsterdam, pp. 344-346; 1985.
Felippe JJ. Radicais Livres como Mecanismo Intermediário de Moléstia. In Felippe Jr. Pronto Socorro: Fisiopatologia – Diagnóstico – Tratamento. Ed.Guanabara –Koogan. 1168-1173,1990.
Felippe JJ. Estratégia Biomolecular: uma das Bases da Medicina do Futuro. Revista Brasileira de Medicina Complementar. 7(1): 8-9,2001.
Felippe JJ . Em Busca do Mecanismo de Ação Único para o Tratamento das Doenças: Energia Livre - ATP. Um ensaio teórico com evidências experimentais. Revista Eletrônica da Associação Brasileira de Medicina Complementar, http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Janeiro. Tema do mês de maio de 2003.
Felippe JJ. Estratégia Terapêutica de Indução da Apoptose, da Inibição da Proliferação Celular e da Inibição da Angiogênese com a Oxidação Tumoral Provocada por Nutrientes Pró Oxidantes. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de fevereiro de 2003.
Felippe JJ. Fluidez da Membrana: possivelmente o ponto mais fraco das células malignas. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de maio de 2004.
Felippe JJ. Fluidez da Membrana: possivelmente o ponto mais fraco das células malignas. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de maio de 2004.
Felippe JJ. Medicina Biomolecular. Revista Brasileira de Medicina Biomolecular e Radicais Livres. 1(1): 6-7,1994. Felippe JJ. Desacetilação como mecanismo de controle epigenético do Câncer: Inibição da Proliferação Celular Maligna, Aumento da Diferenciação Celular e Aumento da Apoptose. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de julho de 2004.
Felippe JJ. Metabolismo da Célula Tumoral - Câncer como um Problema da Bioenergética Mitocondrial: Impedimento da Fosforilação Oxidativa - Fisiopatologia e Perspectivas de Tratamento. Revista Eletrônica da Associação Brasileira de Medicina Complementar. Tema do mês de agosto de 2004.
Felippe JJ. Tratamento do Câncer com Medidas e Drogas que Acordam Genes Silenciados pela Metilação das ilhas CpG do DNA. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de abril de 2004.
Felippe JJ. Tratamento do Câncer com medidas e drogas que inibem o fator nuclear NF-kappaB. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de fevereiro de 2004.
Felippe, J.J. Câncer: população rebelde de células esperando por compaixão e reabilitação. Revista Eletrônica da Associação Brasileira de Medicina Complementar .http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Tema da semana de 16/05/05.
Felippe JJ. Tratamento do Câncer com medidas e drogas que inibem o fator nuclear NF-kappaB. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de fevereiro de 2004.
Felippe JJ . Câncer e Inibidores do STAT-3 : Curcumina , Partenolide e Resveratrol Revista Eletrônica da Associação Brasileira de Medicina Complementar,http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Tema do mês de outubro de 2007.
Felippe JJ . Dicloroacetato e Câncer: Aumenta a Apoptose e Diminui a Proliferação Celular Maligna . Revista Eletrônica da Associação Brasileira de Medicina Complementar, http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Tema do mês de maio de 2007.
Felippe JJ . Câncer e Inibidores da SAP/MAPK (JNK/MAPK , ERK/MAPK , p38/MAPK): Resveratrol , Tangeritina e Ligustilide, Revista Eletrônica da Associação Brasileira de Medicina Complementar, http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Tema do mês de abril de 2008
Felippe JJ. Água: vida-saúde-doença-envelhecimento-câncer:Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de fevereiro de 2008.
Felippe JJ. Desvendando os segredos do câncer. :Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de maio de 2008.
Felippe Jr. Câncer e Tiosulfato de sódio : diminuição da proliferação celular do carcinoma epidermoide humano com um forte estruturador de clusters da água intracelular. Revista Eletrônica da Associação Brasileira de Medicina Revista Eletrônica da Associação Brasileira de Medicina Complementar.http://www.medicinacomplementar.com.br/. , 22/03/2008.
Felippe Jr. Epigalocatequina-galato, ácido ascórbico, prolina, magnésio, cálcio, selênio, cobre e manganês são fortes estruturadores da água intracelular e provocam a inibição da proliferação, da invasividade e das metástases do câncer de pulmão, próstata, mama, pâncreas, bexiga, cérebro, testículo, mesotelioma, melanoma e fibrosarcoma. Revista Eletrônica da Associação Brasileira de Medicina Revista Eletrônica da Associação Brasileira de Medicina Complementar.http://www.medicinacomplementar.com.br/. , junho de 2008 .
Felippe, JJ. Inflamação Crônica Subclínica - Peste Bubônica do Século XXI - Mecanismo Intermediário da Maioria das Moléstias que Afligem a Humanidade. Revista Eletrônica da Associação Brasileira de Medicina Complementar . http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Tema da semana de junho de 2008.
Furlong I.J., Ascaso R., Rivas A.L., Collins M.K.L., Intracellular acidification induces apoptosis by stimulating ICE-like protease activity, J. Cell Sci. 110 653-661; 1997.
Gajate C., Mollinedo F., Biological activities, mechanisms of action and biomedical prospect of the antitumor ether phospholipid ET-18-OCH3 (Edelfosine), a proapoptotic agent in tumor cells, Curr. Drug Metab. 3 491-525; 2002.
Gatenby R.A., Gawlinski E.T., Tangen C.M., Flanigan R.C., Crawford E.D., The possible role of postoperative azotemia in enhanced survival of patients with metastatic renal cancer after cytoreductive nephrectomy, Cancer Res. 62 5218-5222; 2002.
Gerweck LE, Seetharaman K. Cellular pH gradient in tumor versus normal tissue: potential exploitation for the treatment of cancer. Cancer Res 56: 1194-1198; 1996.
Gillies R.J., Zaguilan R.M., Martinez G.M., Serrano R., Perona R., Tumorigenic 3T3 cells maintain an alkaline intracellular pH under physiological conditions, Proc. Natl. Acad, Sci. U.S.A. 87 7414-7418; 1990.
Goldfeder A, Theoretical basis for the acidotic treatment of neoplasia, Am. J. Surg. 19 307-312; 1933.
Goossens J.F., Henichart J.P., Dassonneville L., Facompre M., Bailly C., Relation between intracellular acidification and camptothecin-induced apoptosis in leukemia cells, Eur. J. Pharm. Sci. 10 125-131; 2000.
Gottlieb R.A., Giesing H.A., Zhu J.Y., Engler R.L., Babior B.M., Cell acidification in apoptosis: granulocyte colony-stimulating factor delays programmed cell death in neutrophils by up-regulating the vacuolar H+ -ATPase, Proc. Natl. Acad. Sci. U.S.A. 92 5965-5968; 1995.
Hagmar B., Cell surface charge and metastasis formation, Acta Pathol. Microbiol. Scand. 80, 357-366; 1972.
Hamilton G., Conentini E.P., Teleky B., Koperna T., Zacheri J., Riegler M., Feil W., Schiessel R., Wenzi E., The multidrug-resistance modifiers verapamil, cyclosporine A and tamoxifen induce an intracellular acidification in colon carcinoma cell lines in vitro, Anti-cancer Res. 13(6A) 2059-2063; 1993.
Harguindey S., Kolbeck R.C., Bransome E.D. Jr., Ureterosigmoidos-tomy and cancer: new observations, Ann. Int. Med. 83 833; 1975.
Harguindey S., Pedraz J.L., Cañero R.G., Diego J. P., Cragoe E.J. Jr., Hydrogen íon-dependent oncogenesis and parallel new avenues to câncer prevention and treatment using a H+ -mediated unifying approach: pH-related and pH-unrelated mechanisms, Crit. Rev. Oncog. 6 (1) 1-33; 1995.
Hoffman M.M., Wei L.Y., Roepe P.D., Are altered pHi and membrane potential in hu MDR 1 transfectants sufficient to cause MDR protein-mediated mutidrug resistance? J. Cell. Physiol. 108(4) 295-313; 1996.
Ivanov S; Liao SY; Ivanova A; Danilkovitch-Miagkova A; Tarasova N; Weirich G; Merrill MJ; Proescholdt MA; Oldfield EH; Lee J; Zavada J; Waheed A; Sly W; Lerman MI; Stanbridge EJ. Expression of hypoxia-inducible cell-surface transmembrane carbonic anhydrases in human cancer. Am J Pathol; 158(3): 905-19, Mar 2001.
Johnson JD; Epel D; Intracellular pH and activation of sea urchin eggs after fertilization. Nature 262(5570):661-4; 19 aug 1976.
Keizer H.G., Joenje H., Increased cytosolic pH in multidrug-resistant human lung tumor cells: effect of verapamil, J. Natl. Cancer Inst. 81, 706-709; 1989.
Klein M., Seeger P., Schuricht B., Alper S.L., Schwa A., Polarization of Na+/H+ and CI-/HCO3 exchangers in migrating renal epithelial cells, J. Gen. Physiol. 115, 599-607; 2000.
Kozin SV, Shkarin P, Gerweck LE. The cell transmembrane pH gradient in tumors enhances cytotoxicity of specific weak acid chemotherapeutics. Cancer Res 61: 4740-4743; 2001.
Lagana, A; Vadnais J.; Le P.U., Nguyen T.N., Laprade R., Nabi I.R., Noel J., Regulation of the formation of tumor cell pseudopodia by the Na (+)/H(+) exchanger NHE1, J. Cell Sci. 113, 3649-3662; 2000.
Lagarde A.E., Pouysségur J.M., The Na+/H+ antiport in câncer, Câncer Biochem. Biophys. 9 1-14; 1986.
Lang F., Oberleithner H., Kolb H.A., Paulmichl M., Völkl H., Wang W., Interaction of intracellular pH and cell membrane potential, in: D. Häussinger (Ed.), pH Homeostasis: Mechanisms and Control, Academic Press, London, pp. 27-42; 1988.
Lardner A. The effect of extracellular pH on immune function. J Leukoc Biol; 69: 522-530; 2001.
Lardner, A. The effects of extracellular pH on immune function. Department of Biological sciences, Dublin Institute of Technology, Dublin, Ireland. 2001.
Li J., Eastman A., Apoptosis in an interleukin-2-dependent cytotoxic T lymphocyte cell line is associated with intracellular acidification, role of the Na+/H+ -antiport, J. Biol. Chem. 270 3203-3211; 1995.
Luo J., Tannock I.F., Inhibition of the regulation of intracellular pH: potential of 5-(N,N-hexamethylene) amiloride in tumor-selective therapy, Br. J. Cancer 70 617-624; 1994.
Mahoney E.M, Complete regression of vesical carcinoma following urinary diversion, Am. J. Surg. 100 133-136; 1960.
Marino A.A., Iliev I.G., Schwalke M.A., Gonzalez E., Marler K.C., Flanagan C.A., Association between membrane potential and breast cancer, Tumor Biol. 15, 82-89; 1994.
Matsuyama S., Llopis J., Deveraux Q.L., Tsien R.Y., Reed J.C., Changes in intramitchondrial and cytosolic pH: early events that modulate caspase activation during apoptosis, Nat. Cell Biol. 2 318-325; 2000.
Mayer L.D., Bally M.B., Cullis P.R., Uptake of adriamycin into large unilamellar vesicles in response to a pH gradient, Biochem. Biophys. Acta 857 123-126; 1986.
Mayer W., Cancer-Its Origin, Its Development and Its Self-Perpetuation – The Therapy of Operable and Inoperable Cancer in the Light of a Systemic Conception of Malignancy, Paul B. Hoeber Inc, New York, 1931.
Moolenaar WH, Defize LH, de Laat SW. Calcium in the action of growth factors. Ciba Found Symp. 122: 212-31; 1986.
Moolenaar WH. Effects of growth factors on intracellular pH regulation. Biochem Soc Symp 50: 205-20; 1985.
Moolenar W.H., Tsien R.Y. , Van der Saag P.T, Laat S.W.de, Na+/H+ exchange and cytoplasmatic pH in the action of growth factors in human fibroblasts, Nature 304 645-648; 1983.
Moore K.S., Wehrli S., Roder H., Rogers M., Forrest J.N. Jr., McCrimmon D., Zasloff M., Squalamine: an aminosterol antibiotic from the shark, Proc. Natl. Acad. Sci. 90 1354-158; 1993.
Mori K., Inhibition of experimental production of liver cancer by addition of acetic acid to the diet, Gann 44 429-434; 1953.
Murakami T., Shibuya I., Ise T., Chen Z.S., Akiyama S., Nakagawa M., Izumi H., T. Nakamura T., Matsuo K., Yamada Y., Khono K., Elevated expression of vacuolar proton pump genes and cellular pH in cisplatin resistance, Int. J. Cancer 93 (6) 869-874; 2001.
Orive G., Reshkin S.J., Harguindey S., Pedraz J.L., Hydrogen ion dynamics and the Na+/H+ antiporter in cancer angiogenesis and antiangiogenesis, Br. J. Cancer 89 1395-1399; 2003.
Overbeeke R., Yildirim M., Reutenlingsperper C.P.M., Haanen C., Vermes I.. Sequential occurrence of mitochondrial and plasma membrane alterations, fluctuations in cellular Ca2+ and pH during initial and later phases of cell death, Apoptosis 4 455-460; 1999.
Park H.J., Lyons J.C., Ohtsubo T., Song C.W., Acidic environment causes apoptosis by increasing caspase activity, Br. J. Cancer 80(2) 1892-1897; 1999.
Parkins C.S, Stratford M.R., Dennis M.F, Stubbs M., Chaplin D.J., The relationship between extracellular lactate and tumour pH in a murine tumour model of ischaemia-reperfusion, Br. J. Cancer 75 319-323; 1997.
Perek N., Denoyer D., Dubois F., Koumanov F., Malignant glioma displays altered plasma membrane potential and pH regulation – Interaction with Tc-99m-MIBI and Tc-99m-tetrofosmin uptakes, Gen. Physiol. Biophys. 21, 381-404; 2002.
Perez I.S, Garcia L.G, Perona R., Role of intracellular pH on jun kinase activation induced by UV light, VI Congress of ASEICA, Barcelona, vol.98, p. 251; 1995.
Perona R., Serrano R., Increased pH and tumorigenicity of fibroblasts expressing a yeast proton pump, Nature 334 438-440; 1988.
Pouysségur J., The growth factor activatable Na+/H+ exchange system: a genetic approach, in: A. Bradshaw. S. Prentis (Eds.), Oncogenes and Growth Factors, Elsevier, Amsterdam, pp. 292-297; 1987.
Putney L.K., Barber D.L., Na/H exchange-dependent increase in intracellular pH times G2/M entry and transition, J. Biol. Chem. 278 (45) 44645-44649; 2003.
Raghunand N, Gillies RJ. pH and drug resistance in tumors. Drug Resist Updat 3: 39-47; 2000.
Rebollo A., Gómez J., Aragon A.M. de; Lastres P.; Silva A.; Pérez-Sala, D. Apoptosis induced by IL-2 withdrawal is associated with an intracellular acidification, Exp. Cell Res. 218 581-585; 1995.
Reding E., L’equilibre acide-base et l’equilibre ionique dans le cancer et le precancer, Cancer (Brux) 2 97-152; 1928.
Reding E., Slosse A., Des caracteres generaux de l’etat cancereux et precancereux, Bull. Assoc. Fr. Cancer 18 122-151; 1929.
Reshkin S.J., Bellizzi A., Caldeira S., Albarani V., Malanchi I., Poignee M., Fabbroni M.A., Casavola V., Tommasino M.. Na+/H+ exchanger-dependent intracellular alkalinization is an early event in malignant transformation and plays an essential role in the development of subsequent tranformation-associated phenotypes, FASEB J. 14 2185-2197; 2000.
Reshkin S.J., Bellizzi A., Cardone R.A., Tommasino M., Casavola V., Paradiso A., Paclitaxel induces apoptosis via protein kinase A- and p38 mitogen-activated protein-dependent inhibition of the Na+/H+ exchanger (nHE) Isoform I in human breast cancer cells, Clin. Cancer Res. 9 2366-2373; 2003.
Rich I.R., White O.A.W., Musk P., Apoptosis of leukemic cells accompanies reduction in intracellular pH after targeted inhibition of the Na+/H+ exchanger, Blood 95 1427-1434; 2000.
Rockwell S., Yuan J., Peretz S., Glazer P.M., Genomic instability in cancer, in: R. Gillies (Ed.), The tumor Microenvironment: Causes and Consequences of Hypoxia and Acidity, Novartis Found. Symp., vol 240, John Wiley and Sons, Chichester, NY, pp. 133-142; 2001.
Roepe P.D., pH and multidrug resistance, in: R.J. Gillies (Ed.), The Tumor Microenvironment: Causes and Consequences of Hypoxia and Acidity, Novartis Found. Symp., vol 240, John Wiley and Sons, Chichester, NY, pp. 232-247; 2001.
Roepe P.D., Wei L.Y., Cruz J., Carlson D., Lower electrical membrane and altered pHi homeostasis in multidrug-resistand (MDR) cells: further characterization of a series of MDR cell lines expressing different levels of P-glycoprotein, Biochemistry 32 11042-11056; 1993.
Rotin D., Norwood D.S; Grinstein S., Tannock I., Requirement of the Na+/H+ exchanger for tumor growth, Cancer Res. 49 205-211; 1989.
Rotin D., Wan P.,Grinstein S., Tannock I., Cytotoxicity of compounds that interfere with the regulation of intracellular pH: a potential new class of anticancer drugs, Cancer Res. 47 1497-1504; 1987.
Sala DP; Escobar DC; Mollinedo F. Intracellular alkalinization suppresses lovastatin-induced apoptosis in HL-60 cells through the inactivation of a pH-dependent endonuclease. Br J Cancer Feb; 79(5-6): 793-801; 1999.
Selawry O.S., Swchartz M.R., Growth inhibition of sarcoma 180 by lactic acid, Proc. Am. Soc. Cancer Res. 4 61; 1963.
Severin T, Muller B, Giese G, Uhl B, Wolf B, Hauschildt S, Kreutz W. pH-dependent LAK cell cytotoxicity. Tumours Biol 15: 304-310; 1994.
Shrode L.D., Tapper H., Grinstein S., Role of intracellular pH in proliferation, transformation, and apoptosis, J. Bioenerg. Biomembr. 29 (4) 393-399; 1997.
Soulinna E-M., Buchsbaum R.N., Racker E., the effect of flavonoids on aerobic glycolysis and growth of tumor cells, Cancer Res. 35 1865-1872; 1975.
Sparks R.L., Pool T.B., Smith N.K.R., Cameron I.L., Effects of amiloride on tumor growth and intracellular element content of tumor cells in vivo, Cancer Res. 43 73-77; 1983.
Sun D., Gong Y., Kojima H., Wang G., Ravinsky E., Zhang M., Minuk G.Y., Increasing cell membrane potential and GABAergic activity inhibits malignant hepatocyte growth, Am. J. Physiol.: Gastrointest. Liver Physiol. 285, G12-G19; 2003.
Tannock I.F., Newell K., Rotin D., Therapeutic potential of compounds that inhibit membrane-bound regulation of intracellular pH, Cancer Chem. Pharmacol, 46 (Suppl.2) s85; 1989.
Tannock IF, Rotin D. Acidic pH in tumors and its potential for therapeutic exploitation. Cancer Res 49: 4373-4384; 1989.
Tannock IF; Rotin D. Acid pH in tumors and its potential for therapeutic exploitation. Cancer Res; 49(16): 4373-84, Aug 15 1989.
Terradez P., Asensi M., M.C. Lasso de la Vega, Puertes I.R., Viña J., Estrela J.M., Depletion of tumor glutathione in vivo by buthionine sulphoximine: modulation by the rate of cellular proliferation and inhibition of cancer growth, Biochem. J. 293 477-483; 1993.
Thangaraju, M; Sharma, K; Liu, D; Shen, S.H; Srikant, C.B. Interdependent regulation of intracellular acidification and SHP-1 in apoptosis. Cancer Research 59, 1649-1654, April 1, 1999.
Torigoe T., Izumi H., Ise T., Murakami T., Uramoto H., Ishiguchi H., Yoshida Y., Tanabe M., Nomoto M., Kohno K., Vacuolar H+ -ATPase: functional mechanisms and potential as a target for cancer chemotherapy, anti-cancer Drugs 13 237-243; 2002.
Vairo G., Cockss B.G, Cragoe E.J. Jr., Hamilton J.A., Selective suppression of growth factor-induced cell cycle gene expression by Na+/H+ antiport inhibitors, J.Biol. Chem. 27 19043-19046; 1992.
Vermeulen, ME; Gamberale, R; Trevani, AS; Martínez, D. Ceballos, A; Sabatte, J; Giordano, M; Geffner, JR. The impact of extracellular acidosis on dendritic cell function. Critical Reviews in Immunology, 24(5): 363-383; 2004.
Verne J., Roth P.C., The role of different factors which can present experimental cancer, Arch. Anat. Pathol. 11 137-140; 1963.
Vogt B., Frey F.J., Inhibition of angiogenesis in Kaposi’s sarcoma by captopril, Lancet 349 1148; 1997.
Volpert O.V., Ward W.F., Lingen M.W., Captopril inhibits angiogenesis and slows the growth of experimental tumors in rats, J. Clin. Invest. 98 671-679; 1996.
Wahl M.L., Owen J.A., Burd R., Herlands R.A., Nogami S.S., Rodeck U., Berd D., Leeper D.B., Owen C.S., Regulation of intracellular pH in human melanoma: potential therapeutic implications, Mol. Cancer Ther. 1 617-628; 2002.
Warbug,O , Posener, K and Negelein, E . Ubner den /stoffwechsel der Carcinomzella. Biochem. Z 152:309-344,1924
Weinsburg J.H., Roepe P.D., Dzekunov S., Schenberg D.A., Intracellular pH and multidrug resistance regulate complement-mediated cytotoxicity of nucleated human cells, J. Biol. Chem. 274, 10888-19877; 1999.
Wiggins, PM. Intracellular pH and the structure of cell water. J. theor. Biol. 37, 363-371; 1972.
Wolf Ch M., Reynolds J.E., Morana S.J., Eastman A., The temporal relationship between protein phosphatase. ICE/CED-3 proteases, intracellular acidification, and DNA fragmentation in apoptosis, Exp. Cell Res. 230 22-27; 1997.
Wong P., Kleeman H.W., Tannock I.F., Cytostatic potential of novel agents that inhibit the regulation of intracellular pH, Br. J. Cancer 87 238-245; 2002.
Yamagata M., Hasuda K., Stamato T., Tannock I.F., The contribution of lactic acid to acidification of tumours: studies of variant cells lacking lactate dehydrogenase, Br. J. cancer 77 1726-1731; 1998.
Yamagata M; Tannock IF. The chronic administration of drugs that inhibit the regulation of intracellular pH: in vitro and anti-tumours effects. Br J Cancer; 73(11): 1328-34, Jun 1996.
Zanke B.W, Lee C., Arab S., Tannock I.F., Death of tumor cells after intracellular acidification in dependent on stress-activated protein kinases (SAPK/JNK)pathway activation and cannot be inhibited by Bcl-2 expression or interleukin 1β-converting enzyme inhibition, Cancer Res. 58 2801-2808; 1998.
Zavadova Z; Zavada J. Carbonic anhydrase IX (CA IX) mediates tumor cell interactions with microenvironment. Oncol Rep; 13(5): 977-82, May 2005.
Zettenberg A., Engstrom W., Mitogenic effect of alkalinity on quiescent, serum starved cells, Proc. Natl. Cancer Inst. 78 4334-4438; 1981.
Adachi E., Tannock I.F., The effect of vasodilating drugs on pH of tumors, Oncol. Res. 11 179-185; 1999.
Altan N., Chen Y., Schindler M., Simon S.M., Defective acidification in human breast tumor cells and implications for chemotherapy, J. Exp. Med. 187 1593-1598; 1998.
Anghlieri L.J., Tumor growth inhibition by ammonium chloride induced acidosis, Int. J. Pharmacol. Biopharm. 12 320-326; 1975.
Angoli D., Delia D., Wanke E., Early cytoplasmatic acidification in retinamide-mediated apoptosis of human promyelocitic cells, Biochem. Biophys. Res. Commun. 229 681-685; 1996.
Barry M., Reynolds J.E.,Eastman A., Etoposide-induced apoptosis in human HL-60 cells is associated with intracellular acidification, Cancer Res. 53 2349-2357; 1993.
Becker Y. Anticancer role of dendritic cells (DC) in human and experimental cancers-a review. Anticancer Res 12: 511-520; 1992.
Belhoussine R., Morjani H., Sharonov S., Ploton D., Manfait M., Characterization of intracellular pH gradients in mutidrug-resistant tumor cells by means of scanning microspectrofluorimetry and dual-emission-ratio probes, Int. J. Cancer 81 81-89; 1999.
Belt JA; Thomas JA; Buchsbaum RN; Racker E. Inhibition of lactate transport and glycolysis in Ehrlich ascites tumor cells by bioflavonoids. Biochemistry; 18(16): 3506-11, 7 Aug 1979.
Bhujwalla Z.M., Artemov D., Abooagye E., Ackerstaff E., Gillies R.J., Natarajan K., Solaiyappan M., The physiological environ-ment in cancer vascularization, invasion and metastasis, in: R.J. Gillies (Ed), The Tumor Microenvironment: Causes and Consequences of Hypoxia and Acidity, Novartis Found. Symp., vol. 240, John Wiley and Sons, Chichester, NY, pp. 23-38; 2001.
Bingelli R., Cameron I.L., Cellular potentials of normal and cancerous fibroblasts and hepatocytes, Cancer Res. 40, 1830-1835; 1980
Boscoboinik D., Gupta R.S., Epand R.M., Altered intracellular pH and Na+/H+ antiport activity in multidrug resistance cell lines, Cancer Chem. Pharmacol. 24 s86; 1989.
Bourguignon L.Y., Singleton P.A., Diedrich F., Stern R., Gilad E., CD44 interaction with Na+ -H+ exchanger (NHEI) creates acidic microenvironments leading to hyaluronidase-2 and cathepsin B activation and breast tumor cell invasion, J. Biol. Chem. 279; 26991-27007; 2004.
Cameron I.L., Intervention of sodium flux as a target for cancer chemotherapy, New Approaches to Cancer Chemotherapy, Academic Press, New York, pp. 355-374; 1984.
Cañero R.G., Na+/H+ antiport, in: F.L. Crane, D.J. Morré, H. Löw (Eds.), Oxidoreduction at the Plasma Membrane: Relation to Growth and Transport, CRC Press, Boca Raton, pp. 237-246; 1990.
Cañero R.G., Trilla C., J. Diego J.P., Gil J.J.D., Cobo J.M., Na+: H+ exchange inhibition induces intracellular acidosis and differentially impairs cell growth and viability of human and rat hepatocarcinoma cells, Toxicol. Lett. 106 215-228; 1999.
Ceccarini C; Eagle H. Induction and reversal of contact inhibition of growth by pH modification. Nature New Biology vol 233 october 27 1971.
Chien EJ, Liao CF, Chang CP, Pu HF, Lu LM; Shie MC; Hsieh DJ; Hsu MT. The non-genomic effects on Na+/H+ -exchange 1 by progesterone and 20 alphahydroxyprogesterone in human T cells. J. Cell Physiol, 211(2): 544-50; May 2007.
Cone Jr C.D., Unified theory on the basic mechanism of normal control and oncogenesis, J. Theor. Biol. 30, 151-181; 1971.
Crowther M, Brown NJ, Bishop ET, Lewis CE. Microenvironmental influence on macrophage regulation and angiogenesis in wounds nad malignant tumors. J Leukoc Biol 70: 478-490; 2001.
Crowther M.; Brow N.J.; Bishop, ET; Lewis, CE. Microenvironmental influence on macrophage regulation of angiogenesis in wounds and malignant tumors. Biol. 70: 478-490; 2001.
Dadabayev AR, Sandel MH, Menon AG, Morreau H, Melief CJ, Offringa R, Van Der Burg SH, Rhijn CJ, Ensink NG, Tollenaar RA, Van De Velde CJ, Kuppen PJ. Dendritic cells in colorectal cancer correlate with other tumor-infiltrating immune cells. Cancer Immunol Immunother 53: 978-986; 2004.
Denker P., Barber D.L., Ion transport proteins anchor and regulate the cytoskeleton, Curr. Opin. Cell Biol. 14 214-220; 2002.
DiGiammarino J., Lee A.D.S., Cadwell C., Zhang W., Bothner B.; Ribeiro R.C, Zambetti G., Kriwacki R.W., A novel mechanism of tumorogenesis involving pH-dependent destabilization of a mutant p53 tetramer, Nat. Struct. Biol.(1) 12-16; 2000.
Doppler W., Maly K., Hofmann J., Grunicke H., Inhibition of tumor cell growth by interference with growth factor induced cell proliferation, in: T. Galeotti, A. Cittadini, G. Neri, S. Papa, L.A. Smets (Eds.), Cell Membranes and Cancer, Elsevier, Amsterdam, pp. 344-346; 1985.
Felippe JJ. Radicais Livres como Mecanismo Intermediário de Moléstia. In Felippe Jr. Pronto Socorro: Fisiopatologia – Diagnóstico – Tratamento. Ed.Guanabara –Koogan. 1168-1173,1990.
Felippe JJ. Estratégia Biomolecular: uma das Bases da Medicina do Futuro. Revista Brasileira de Medicina Complementar. 7(1): 8-9,2001.
Felippe JJ . Em Busca do Mecanismo de Ação Único para o Tratamento das Doenças: Energia Livre - ATP. Um ensaio teórico com evidências experimentais. Revista Eletrônica da Associação Brasileira de Medicina Complementar, http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Janeiro. Tema do mês de maio de 2003.
Felippe JJ. Estratégia Terapêutica de Indução da Apoptose, da Inibição da Proliferação Celular e da Inibição da Angiogênese com a Oxidação Tumoral Provocada por Nutrientes Pró Oxidantes. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de fevereiro de 2003.
Felippe JJ. Fluidez da Membrana: possivelmente o ponto mais fraco das células malignas. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de maio de 2004.
Felippe JJ. Fluidez da Membrana: possivelmente o ponto mais fraco das células malignas. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de maio de 2004.
Felippe JJ. Medicina Biomolecular. Revista Brasileira de Medicina Biomolecular e Radicais Livres. 1(1): 6-7,1994. Felippe JJ. Desacetilação como mecanismo de controle epigenético do Câncer: Inibição da Proliferação Celular Maligna, Aumento da Diferenciação Celular e Aumento da Apoptose. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de julho de 2004.
Felippe JJ. Metabolismo da Célula Tumoral - Câncer como um Problema da Bioenergética Mitocondrial: Impedimento da Fosforilação Oxidativa - Fisiopatologia e Perspectivas de Tratamento. Revista Eletrônica da Associação Brasileira de Medicina Complementar. Tema do mês de agosto de 2004.
Felippe JJ. Tratamento do Câncer com Medidas e Drogas que Acordam Genes Silenciados pela Metilação das ilhas CpG do DNA. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de abril de 2004.
Felippe JJ. Tratamento do Câncer com medidas e drogas que inibem o fator nuclear NF-kappaB. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de fevereiro de 2004.
Felippe, J.J. Câncer: população rebelde de células esperando por compaixão e reabilitação. Revista Eletrônica da Associação Brasileira de Medicina Complementar .http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Tema da semana de 16/05/05.
Felippe JJ. Tratamento do Câncer com medidas e drogas que inibem o fator nuclear NF-kappaB. Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de fevereiro de 2004.
Felippe JJ . Câncer e Inibidores do STAT-3 : Curcumina , Partenolide e Resveratrol Revista Eletrônica da Associação Brasileira de Medicina Complementar,http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Tema do mês de outubro de 2007.
Felippe JJ . Dicloroacetato e Câncer: Aumenta a Apoptose e Diminui a Proliferação Celular Maligna . Revista Eletrônica da Associação Brasileira de Medicina Complementar, http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Tema do mês de maio de 2007.
Felippe JJ . Câncer e Inibidores da SAP/MAPK (JNK/MAPK , ERK/MAPK , p38/MAPK): Resveratrol , Tangeritina e Ligustilide, Revista Eletrônica da Associação Brasileira de Medicina Complementar, http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Tema do mês de abril de 2008
Felippe JJ. Água: vida-saúde-doença-envelhecimento-câncer:Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de fevereiro de 2008.
Felippe JJ. Desvendando os segredos do câncer. :Revista Eletrônica da Associação Brasileira de Medicina Complementar. www.medicinacomplementar.com.br. Tema do mês de maio de 2008.
Felippe Jr. Câncer e Tiosulfato de sódio : diminuição da proliferação celular do carcinoma epidermoide humano com um forte estruturador de clusters da água intracelular. Revista Eletrônica da Associação Brasileira de Medicina Revista Eletrônica da Associação Brasileira de Medicina Complementar.http://www.medicinacomplementar.com.br/. , 22/03/2008.
Felippe Jr. Epigalocatequina-galato, ácido ascórbico, prolina, magnésio, cálcio, selênio, cobre e manganês são fortes estruturadores da água intracelular e provocam a inibição da proliferação, da invasividade e das metástases do câncer de pulmão, próstata, mama, pâncreas, bexiga, cérebro, testículo, mesotelioma, melanoma e fibrosarcoma. Revista Eletrônica da Associação Brasileira de Medicina Revista Eletrônica da Associação Brasileira de Medicina Complementar.http://www.medicinacomplementar.com.br/. , junho de 2008 .
Felippe, JJ. Inflamação Crônica Subclínica - Peste Bubônica do Século XXI - Mecanismo Intermediário da Maioria das Moléstias que Afligem a Humanidade. Revista Eletrônica da Associação Brasileira de Medicina Complementar . http://www.medicinacomplementar.com.br/ . Biblioteca de Câncer. Tema da semana de junho de 2008.
Furlong I.J., Ascaso R., Rivas A.L., Collins M.K.L., Intracellular acidification induces apoptosis by stimulating ICE-like protease activity, J. Cell Sci. 110 653-661; 1997.
Gajate C., Mollinedo F., Biological activities, mechanisms of action and biomedical prospect of the antitumor ether phospholipid ET-18-OCH3 (Edelfosine), a proapoptotic agent in tumor cells, Curr. Drug Metab. 3 491-525; 2002.
Gatenby R.A., Gawlinski E.T., Tangen C.M., Flanigan R.C., Crawford E.D., The possible role of postoperative azotemia in enhanced survival of patients with metastatic renal cancer after cytoreductive nephrectomy, Cancer Res. 62 5218-5222; 2002.
Gerweck LE, Seetharaman K. Cellular pH gradient in tumor versus normal tissue: potential exploitation for the treatment of cancer. Cancer Res 56: 1194-1198; 1996.
Gillies R.J., Zaguilan R.M., Martinez G.M., Serrano R., Perona R., Tumorigenic 3T3 cells maintain an alkaline intracellular pH under physiological conditions, Proc. Natl. Acad, Sci. U.S.A. 87 7414-7418; 1990.
Goldfeder A, Theoretical basis for the acidotic treatment of neoplasia, Am. J. Surg. 19 307-312; 1933.
Goossens J.F., Henichart J.P., Dassonneville L., Facompre M., Bailly C., Relation between intracellular acidification and camptothecin-induced apoptosis in leukemia cells, Eur. J. Pharm. Sci. 10 125-131; 2000.
Gottlieb R.A., Giesing H.A., Zhu J.Y., Engler R.L., Babior B.M., Cell acidification in apoptosis: granulocyte colony-stimulating factor delays programmed cell death in neutrophils by up-regulating the vacuolar H+ -ATPase, Proc. Natl. Acad. Sci. U.S.A. 92 5965-5968; 1995.
Hagmar B., Cell surface charge and metastasis formation, Acta Pathol. Microbiol. Scand. 80, 357-366; 1972.
Hamilton G., Conentini E.P., Teleky B., Koperna T., Zacheri J., Riegler M., Feil W., Schiessel R., Wenzi E., The multidrug-resistance modifiers verapamil, cyclosporine A and tamoxifen induce an intracellular acidification in colon carcinoma cell lines in vitro, Anti-cancer Res. 13(6A) 2059-2063; 1993.
Harguindey S., Kolbeck R.C., Bransome E.D. Jr., Ureterosigmoidos-tomy and cancer: new observations, Ann. Int. Med. 83 833; 1975.
Harguindey S., Pedraz J.L., Cañero R.G., Diego J. P., Cragoe E.J. Jr., Hydrogen íon-dependent oncogenesis and parallel new avenues to câncer prevention and treatment using a H+ -mediated unifying approach: pH-related and pH-unrelated mechanisms, Crit. Rev. Oncog. 6 (1) 1-33; 1995.
Hoffman M.M., Wei L.Y., Roepe P.D., Are altered pHi and membrane potential in hu MDR 1 transfectants sufficient to cause MDR protein-mediated mutidrug resistance? J. Cell. Physiol. 108(4) 295-313; 1996.
Ivanov S; Liao SY; Ivanova A; Danilkovitch-Miagkova A; Tarasova N; Weirich G; Merrill MJ; Proescholdt MA; Oldfield EH; Lee J; Zavada J; Waheed A; Sly W; Lerman MI; Stanbridge EJ. Expression of hypoxia-inducible cell-surface transmembrane carbonic anhydrases in human cancer. Am J Pathol; 158(3): 905-19, Mar 2001.
Johnson JD; Epel D; Intracellular pH and activation of sea urchin eggs after fertilization. Nature 262(5570):661-4; 19 aug 1976.
Keizer H.G., Joenje H., Increased cytosolic pH in multidrug-resistant human lung tumor cells: effect of verapamil, J. Natl. Cancer Inst. 81, 706-709; 1989.
Klein M., Seeger P., Schuricht B., Alper S.L., Schwa A., Polarization of Na+/H+ and CI-/HCO3 exchangers in migrating renal epithelial cells, J. Gen. Physiol. 115, 599-607; 2000.
Kozin SV, Shkarin P, Gerweck LE. The cell transmembrane pH gradient in tumors enhances cytotoxicity of specific weak acid chemotherapeutics. Cancer Res 61: 4740-4743; 2001.
Lagana, A; Vadnais J.; Le P.U., Nguyen T.N., Laprade R., Nabi I.R., Noel J., Regulation of the formation of tumor cell pseudopodia by the Na (+)/H(+) exchanger NHE1, J. Cell Sci. 113, 3649-3662; 2000.
Lagarde A.E., Pouysségur J.M., The Na+/H+ antiport in câncer, Câncer Biochem. Biophys. 9 1-14; 1986.
Lang F., Oberleithner H., Kolb H.A., Paulmichl M., Völkl H., Wang W., Interaction of intracellular pH and cell membrane potential, in: D. Häussinger (Ed.), pH Homeostasis: Mechanisms and Control, Academic Press, London, pp. 27-42; 1988.
Lardner A. The effect of extracellular pH on immune function. J Leukoc Biol; 69: 522-530; 2001.
Lardner, A. The effects of extracellular pH on immune function. Department of Biological sciences, Dublin Institute of Technology, Dublin, Ireland. 2001.
Li J., Eastman A., Apoptosis in an interleukin-2-dependent cytotoxic T lymphocyte cell line is associated with intracellular acidification, role of the Na+/H+ -antiport, J. Biol. Chem. 270 3203-3211; 1995.
Luo J., Tannock I.F., Inhibition of the regulation of intracellular pH: potential of 5-(N,N-hexamethylene) amiloride in tumor-selective therapy, Br. J. Cancer 70 617-624; 1994.
Mahoney E.M, Complete regression of vesical carcinoma following urinary diversion, Am. J. Surg. 100 133-136; 1960.
Marino A.A., Iliev I.G., Schwalke M.A., Gonzalez E., Marler K.C., Flanagan C.A., Association between membrane potential and breast cancer, Tumor Biol. 15, 82-89; 1994.
Matsuyama S., Llopis J., Deveraux Q.L., Tsien R.Y., Reed J.C., Changes in intramitchondrial and cytosolic pH: early events that modulate caspase activation during apoptosis, Nat. Cell Biol. 2 318-325; 2000.
Mayer L.D., Bally M.B., Cullis P.R., Uptake of adriamycin into large unilamellar vesicles in response to a pH gradient, Biochem. Biophys. Acta 857 123-126; 1986.
Mayer W., Cancer-Its Origin, Its Development and Its Self-Perpetuation – The Therapy of Operable and Inoperable Cancer in the Light of a Systemic Conception of Malignancy, Paul B. Hoeber Inc, New York, 1931.
Moolenaar WH, Defize LH, de Laat SW. Calcium in the action of growth factors. Ciba Found Symp. 122: 212-31; 1986.
Moolenaar WH. Effects of growth factors on intracellular pH regulation. Biochem Soc Symp 50: 205-20; 1985.
Moolenar W.H., Tsien R.Y. , Van der Saag P.T, Laat S.W.de, Na+/H+ exchange and cytoplasmatic pH in the action of growth factors in human fibroblasts, Nature 304 645-648; 1983.
Moore K.S., Wehrli S., Roder H., Rogers M., Forrest J.N. Jr., McCrimmon D., Zasloff M., Squalamine: an aminosterol antibiotic from the shark, Proc. Natl. Acad. Sci. 90 1354-158; 1993.
Mori K., Inhibition of experimental production of liver cancer by addition of acetic acid to the diet, Gann 44 429-434; 1953.
Murakami T., Shibuya I., Ise T., Chen Z.S., Akiyama S., Nakagawa M., Izumi H., T. Nakamura T., Matsuo K., Yamada Y., Khono K., Elevated expression of vacuolar proton pump genes and cellular pH in cisplatin resistance, Int. J. Cancer 93 (6) 869-874; 2001.
Orive G., Reshkin S.J., Harguindey S., Pedraz J.L., Hydrogen ion dynamics and the Na+/H+ antiporter in cancer angiogenesis and antiangiogenesis, Br. J. Cancer 89 1395-1399; 2003.
Overbeeke R., Yildirim M., Reutenlingsperper C.P.M., Haanen C., Vermes I.. Sequential occurrence of mitochondrial and plasma membrane alterations, fluctuations in cellular Ca2+ and pH during initial and later phases of cell death, Apoptosis 4 455-460; 1999.
Park H.J., Lyons J.C., Ohtsubo T., Song C.W., Acidic environment causes apoptosis by increasing caspase activity, Br. J. Cancer 80(2) 1892-1897; 1999.
Parkins C.S, Stratford M.R., Dennis M.F, Stubbs M., Chaplin D.J., The relationship between extracellular lactate and tumour pH in a murine tumour model of ischaemia-reperfusion, Br. J. Cancer 75 319-323; 1997.
Perek N., Denoyer D., Dubois F., Koumanov F., Malignant glioma displays altered plasma membrane potential and pH regulation – Interaction with Tc-99m-MIBI and Tc-99m-tetrofosmin uptakes, Gen. Physiol. Biophys. 21, 381-404; 2002.
Perez I.S, Garcia L.G, Perona R., Role of intracellular pH on jun kinase activation induced by UV light, VI Congress of ASEICA, Barcelona, vol.98, p. 251; 1995.
Perona R., Serrano R., Increased pH and tumorigenicity of fibroblasts expressing a yeast proton pump, Nature 334 438-440; 1988.
Pouysségur J., The growth factor activatable Na+/H+ exchange system: a genetic approach, in: A. Bradshaw. S. Prentis (Eds.), Oncogenes and Growth Factors, Elsevier, Amsterdam, pp. 292-297; 1987.
Putney L.K., Barber D.L., Na/H exchange-dependent increase in intracellular pH times G2/M entry and transition, J. Biol. Chem. 278 (45) 44645-44649; 2003.
Raghunand N, Gillies RJ. pH and drug resistance in tumors. Drug Resist Updat 3: 39-47; 2000.
Rebollo A., Gómez J., Aragon A.M. de; Lastres P.; Silva A.; Pérez-Sala, D. Apoptosis induced by IL-2 withdrawal is associated with an intracellular acidification, Exp. Cell Res. 218 581-585; 1995.
Reding E., L’equilibre acide-base et l’equilibre ionique dans le cancer et le precancer, Cancer (Brux) 2 97-152; 1928.
Reding E., Slosse A., Des caracteres generaux de l’etat cancereux et precancereux, Bull. Assoc. Fr. Cancer 18 122-151; 1929.
Reshkin S.J., Bellizzi A., Caldeira S., Albarani V., Malanchi I., Poignee M., Fabbroni M.A., Casavola V., Tommasino M.. Na+/H+ exchanger-dependent intracellular alkalinization is an early event in malignant transformation and plays an essential role in the development of subsequent tranformation-associated phenotypes, FASEB J. 14 2185-2197; 2000.
Reshkin S.J., Bellizzi A., Cardone R.A., Tommasino M., Casavola V., Paradiso A., Paclitaxel induces apoptosis via protein kinase A- and p38 mitogen-activated protein-dependent inhibition of the Na+/H+ exchanger (nHE) Isoform I in human breast cancer cells, Clin. Cancer Res. 9 2366-2373; 2003.
Rich I.R., White O.A.W., Musk P., Apoptosis of leukemic cells accompanies reduction in intracellular pH after targeted inhibition of the Na+/H+ exchanger, Blood 95 1427-1434; 2000.
Rockwell S., Yuan J., Peretz S., Glazer P.M., Genomic instability in cancer, in: R. Gillies (Ed.), The tumor Microenvironment: Causes and Consequences of Hypoxia and Acidity, Novartis Found. Symp., vol 240, John Wiley and Sons, Chichester, NY, pp. 133-142; 2001.
Roepe P.D., pH and multidrug resistance, in: R.J. Gillies (Ed.), The Tumor Microenvironment: Causes and Consequences of Hypoxia and Acidity, Novartis Found. Symp., vol 240, John Wiley and Sons, Chichester, NY, pp. 232-247; 2001.
Roepe P.D., Wei L.Y., Cruz J., Carlson D., Lower electrical membrane and altered pHi homeostasis in multidrug-resistand (MDR) cells: further characterization of a series of MDR cell lines expressing different levels of P-glycoprotein, Biochemistry 32 11042-11056; 1993.
Rotin D., Norwood D.S; Grinstein S., Tannock I., Requirement of the Na+/H+ exchanger for tumor growth, Cancer Res. 49 205-211; 1989.
Rotin D., Wan P.,Grinstein S., Tannock I., Cytotoxicity of compounds that interfere with the regulation of intracellular pH: a potential new class of anticancer drugs, Cancer Res. 47 1497-1504; 1987.
Sala DP; Escobar DC; Mollinedo F. Intracellular alkalinization suppresses lovastatin-induced apoptosis in HL-60 cells through the inactivation of a pH-dependent endonuclease. Br J Cancer Feb; 79(5-6): 793-801; 1999.
Selawry O.S., Swchartz M.R., Growth inhibition of sarcoma 180 by lactic acid, Proc. Am. Soc. Cancer Res. 4 61; 1963.
Severin T, Muller B, Giese G, Uhl B, Wolf B, Hauschildt S, Kreutz W. pH-dependent LAK cell cytotoxicity. Tumours Biol 15: 304-310; 1994.
Shrode L.D., Tapper H., Grinstein S., Role of intracellular pH in proliferation, transformation, and apoptosis, J. Bioenerg. Biomembr. 29 (4) 393-399; 1997.
Soulinna E-M., Buchsbaum R.N., Racker E., the effect of flavonoids on aerobic glycolysis and growth of tumor cells, Cancer Res. 35 1865-1872; 1975.
Sparks R.L., Pool T.B., Smith N.K.R., Cameron I.L., Effects of amiloride on tumor growth and intracellular element content of tumor cells in vivo, Cancer Res. 43 73-77; 1983.
Sun D., Gong Y., Kojima H., Wang G., Ravinsky E., Zhang M., Minuk G.Y., Increasing cell membrane potential and GABAergic activity inhibits malignant hepatocyte growth, Am. J. Physiol.: Gastrointest. Liver Physiol. 285, G12-G19; 2003.
Tannock I.F., Newell K., Rotin D., Therapeutic potential of compounds that inhibit membrane-bound regulation of intracellular pH, Cancer Chem. Pharmacol, 46 (Suppl.2) s85; 1989.
Tannock IF, Rotin D. Acidic pH in tumors and its potential for therapeutic exploitation. Cancer Res 49: 4373-4384; 1989.
Tannock IF; Rotin D. Acid pH in tumors and its potential for therapeutic exploitation. Cancer Res; 49(16): 4373-84, Aug 15 1989.
Terradez P., Asensi M., M.C. Lasso de la Vega, Puertes I.R., Viña J., Estrela J.M., Depletion of tumor glutathione in vivo by buthionine sulphoximine: modulation by the rate of cellular proliferation and inhibition of cancer growth, Biochem. J. 293 477-483; 1993.
Thangaraju, M; Sharma, K; Liu, D; Shen, S.H; Srikant, C.B. Interdependent regulation of intracellular acidification and SHP-1 in apoptosis. Cancer Research 59, 1649-1654, April 1, 1999.
Torigoe T., Izumi H., Ise T., Murakami T., Uramoto H., Ishiguchi H., Yoshida Y., Tanabe M., Nomoto M., Kohno K., Vacuolar H+ -ATPase: functional mechanisms and potential as a target for cancer chemotherapy, anti-cancer Drugs 13 237-243; 2002.
Vairo G., Cockss B.G, Cragoe E.J. Jr., Hamilton J.A., Selective suppression of growth factor-induced cell cycle gene expression by Na+/H+ antiport inhibitors, J.Biol. Chem. 27 19043-19046; 1992.
Vermeulen, ME; Gamberale, R; Trevani, AS; Martínez, D. Ceballos, A; Sabatte, J; Giordano, M; Geffner, JR. The impact of extracellular acidosis on dendritic cell function. Critical Reviews in Immunology, 24(5): 363-383; 2004.
Verne J., Roth P.C., The role of different factors which can present experimental cancer, Arch. Anat. Pathol. 11 137-140; 1963.
Vogt B., Frey F.J., Inhibition of angiogenesis in Kaposi’s sarcoma by captopril, Lancet 349 1148; 1997.
Volpert O.V., Ward W.F., Lingen M.W., Captopril inhibits angiogenesis and slows the growth of experimental tumors in rats, J. Clin. Invest. 98 671-679; 1996.
Wahl M.L., Owen J.A., Burd R., Herlands R.A., Nogami S.S., Rodeck U., Berd D., Leeper D.B., Owen C.S., Regulation of intracellular pH in human melanoma: potential therapeutic implications, Mol. Cancer Ther. 1 617-628; 2002.
Warbug,O , Posener, K and Negelein, E . Ubner den /stoffwechsel der Carcinomzella. Biochem. Z 152:309-344,1924
Weinsburg J.H., Roepe P.D., Dzekunov S., Schenberg D.A., Intracellular pH and multidrug resistance regulate complement-mediated cytotoxicity of nucleated human cells, J. Biol. Chem. 274, 10888-19877; 1999.
Wiggins, PM. Intracellular pH and the structure of cell water. J. theor. Biol. 37, 363-371; 1972.
Wolf Ch M., Reynolds J.E., Morana S.J., Eastman A., The temporal relationship between protein phosphatase. ICE/CED-3 proteases, intracellular acidification, and DNA fragmentation in apoptosis, Exp. Cell Res. 230 22-27; 1997.
Wong P., Kleeman H.W., Tannock I.F., Cytostatic potential of novel agents that inhibit the regulation of intracellular pH, Br. J. Cancer 87 238-245; 2002.
Yamagata M., Hasuda K., Stamato T., Tannock I.F., The contribution of lactic acid to acidification of tumours: studies of variant cells lacking lactate dehydrogenase, Br. J. cancer 77 1726-1731; 1998.
Yamagata M; Tannock IF. The chronic administration of drugs that inhibit the regulation of intracellular pH: in vitro and anti-tumours effects. Br J Cancer; 73(11): 1328-34, Jun 1996.
Zanke B.W, Lee C., Arab S., Tannock I.F., Death of tumor cells after intracellular acidification in dependent on stress-activated protein kinases (SAPK/JNK)pathway activation and cannot be inhibited by Bcl-2 expression or interleukin 1β-converting enzyme inhibition, Cancer Res. 58 2801-2808; 1998.
Zavadova Z; Zavada J. Carbonic anhydrase IX (CA IX) mediates tumor cell interactions with microenvironment. Oncol Rep; 13(5): 977-82, May 2005.
Zettenberg A., Engstrom W., Mitogenic effect of alkalinity on quiescent, serum starved cells, Proc. Natl. Cancer Inst. 78 4334-4438; 1981.








































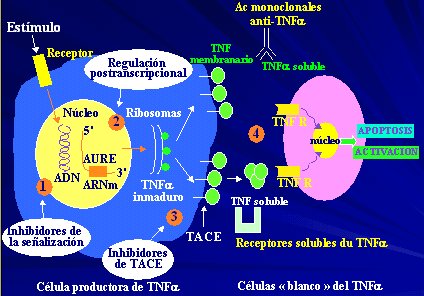


.jpg)

.jpg)





.jpg)
.jpg)


.jpg)

.jpg)
Nenhum comentário:
Postar um comentário
Todos podem comentar e seus comentários receberão uma resposta e uma atenção personalizada. Seu comentário é muito bem vindo. Esse espaço é para participar. Te aguardamos e queremos seu comentário, mesmo desfavorável. Eles não receberão censura. Poderão apenas receber respostas, ou tréplicas.